ra và xác định phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu.
(Biết các phản ứng xảy ra như sau:
Fe + HNO ------> Fe(NO ) + NO + H O
Cu + HNO _-------> Cu(NO ) + NO + H O )
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

$a)PTHH:2Al+6HCl\to 2AlCl_3+3H_2$
$n_{H_2}=\dfrac{5,04}{22,4}=0,225(mol)$
$\Rightarrow n_{Al}=0,15(mol)$
$\Rightarrow \%m_{Al}=\dfrac{0,15.27}{9,45}.100\%\approx 42,86\%$
$\Rightarrow \%m_{Cu}=100-42,86=57,14\%$
$b)$ Theo PT: $n_{HCl}=2n_{H_2}=0,45(mol)$
$\Rightarrow C_{M_{HCl}}=\dfrac{0,45.110\%}{0,5}=0,99M$

a) PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a_____2a______a_____a (mol)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
b_____3b_______b_____\(\dfrac{3}{2}\)b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}56a+27b=36,1\\a+\dfrac{3}{2}b=\dfrac{21,28}{22,4}=0,95\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,5\\b=0,3\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,5\cdot56=28\left(g\right)\\m_{Al}=8,1\left(g\right)\end{matrix}\right.\)
b+c) Theo các PTHH: \(\left\{{}\begin{matrix}n_{HCl}=2a+3b=1,9\left(mol\right)\\n_{FeCl_2}=0,5\left(mol\right)\\n_{AlCl_3}=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C_{M_{HCl}}=\dfrac{1,9}{0,2}=9,5\left(M\right)\\C_{M_{FeCl_2}}=\dfrac{0,5}{0,2}=2,5\left(M\right)\\C_{M_{AlCl_3}}=\dfrac{0,3}{0,2}=1,5\left(M\right)\end{matrix}\right.\)

Gọi a,b lần lượt là số mol của Al, Fe trong hỗn hợp ban đầu
=> 27a+56b=8,3 (1)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25mol\)
Ta có quá trình trao đổi elcetron
\(Al^0\rightarrow Al^{+3}+3e\)
a----------------3a--(mol)
\(Fe^0\rightarrow Fe^{+2}+2e\)
b----------------2b--(mol)
\(2H^{-1}+2e\rightarrow H_2^0\)
----------0,5------0,25-(mol)
Áp dụng định luật bảo toàn e ta có: 3a+2b=0,5 (2)
Giải hệ phương trình gồm (1) và (2) ta được: \(\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\left[{}\begin{matrix}m_{Al}=0,1\cdot27=2,7g\\m_{Fe}=0,1\cdot56=5,6g\end{matrix}\right.\)

a) Gọi số mol Mg, Al là a, b (mol)
=> 24a + 27b = 1,98 (1)
PTHH: Mg + 2HCl --> MgCl2 + H2
a--->2a-------->a---->a
2Al + 6HCl --> 2AlCl3 + 3H2
b---->3b------->b----->1,5b
=> \(n_{H_2}=a+1,5b=\dfrac{2,352}{22,4}=0,105\left(mol\right)\) (2)
(1)(2) => a = 0,015 (mol); b = 0,06 (mol)
\(\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,015.24}{1,98}.100\%=18,18\%\\\%m_{Al}=\dfrac{0,06.27}{1,98}.100\%=81,82\%\end{matrix}\right.\)
b)
\(\left\{{}\begin{matrix}m_{MgCl_2}=0,015.95=1,425\left(g\right)\\m_{AlCl_3}=0,06.133,5=8,01\left(g\right)\end{matrix}\right.\)
\(\left\{{}\begin{matrix}C_{M\left(MgCl_2\right)}=\dfrac{0,015}{0,16}=0,09375M\\C_{M\left(AlCl_3\right)}=\dfrac{0,06}{0,16}=0,375M\\C_{M\left(HCl.dư\right)}=\dfrac{0,16.1,5-0,015.20,06.2}{0,16}=0,5625M\end{matrix}\right.\)

Đáp án D
Trong dung dịch axit, ta có :
n Cl - = n HCl = 0 , 3 mol
n SO 4 2 - = n H 2 SO 4 = 0 , 15 mol
Sơ đồ phản ứng :

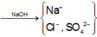
Cho NaOH vào X để thu được kết tủa lớn nhất thì dung dịch sau phản ứng chỉ còn các ion Na + , Cl - và SO 4 2 - .
Áp dụng bảo toàn điện tích trong dung dịch sau phản ứng và bảo toàn nguyên tố Na, ta có :
n NaOH = n Na + = n Cl - + 2 n SO 4 2 - = 0,6 mol
→ V dd NaOH 1 M = 0,6 lit = 600ml

a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Gọi: \(\left\{{}\begin{matrix}n_{Zn}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\) ⇒ 65x + 27y = 17,05 (1)
Ta có: \(n_{H_2}=\dfrac{9,52}{22,4}=0,425\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}+\dfrac{3}{2}n_{Al}=x+\dfrac{3}{2}y=0,425\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=0,2\left(mol\right)\\n_{Al}=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Zn}=0,2.65=13\left(g\right)\\m_{Al}=0,15.27=4,05\left(g\right)\end{matrix}\right.\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{ZnCl_2}=n_{Zn}=0,2\left(mol\right)\\n_{AlCl_3}=n_{Al}=0,15\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C_{M_{ZnCl_2}}=\dfrac{0,2}{0,5}=0,4\left(M\right)\\C_{M_{AlCl_3}}=\dfrac{0,15}{0,5}=0,3\left(M\right)\end{matrix}\right.\)
c, Ta có: m dd HCl = 1,05.500 = 525 (g)
m dd sau pư = mhh + m dd HCl - mH2 = 541,2 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{ZnCl_2}=\dfrac{0,2.136}{541,2}.100\%\approx5,03\%\\C\%_{AlCl_3}=\dfrac{0,15.133,5}{541,2}.100\%\approx3,7\%\end{matrix}\right.\)
bài 5
Fe+6 HNO3 đặc → Fe(NO3)3+ 3NO2+3 H2O
Cu+ 4HNO3→ Cu(NO3)2+ 2NO2+2 H2O
Đặt nFe= xmol; nCu= y mol
Ta có mhhX= 56x+ 64y= 12,0
Số mol khí NO2 là nNO2= 3x+ 2y= 0,5 mol
Giải hệ có x= 0,1; y=0,1 → %mFe=46,67%
=>%mCu=53,33%
Bài 1 :
\(n_{HCl}=0,7.1=0,7\left(mol\right)\)
\(n_{H2}=\frac{5,6}{22,4}=0,25\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
a______6a_____________3a
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
b_______2b____________b
Giải hệ PT:
\(\left\{{}\begin{matrix}27a+56b=8,3\\3a+b=0,25\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,04\\b=0,129\end{matrix}\right.\)
\(\Rightarrow\%_{Fe}=\frac{0,04.56.100}{8,3}=26,98\%\)
\(\Rightarrow\%_{Al}=100\%-26,98\%=73\%\)