Bài 1: Biết M và % khối lượng các nguyên tố, lập công thức phân tử hợp chất hữu cơ không qua công thức đơn giản
A. Hợp chất A gồm C, H trong đó % C = 92,31% . Khối lượng mol A bằng 78g/mol.
B. Hợp chất B gồm C, H và Cl trong đó % Cl = 70,3%; %H = 5,94%. Khối lượng mol B bằng 50,5 g/mol.
Bài 2: Lập công thức phân tử hợp chất hữu cơ qua phương trình hóa học
Xác định CTPT, viết CTCT của các hợp chất sau, biết:
Oxi hóa hoàn toàn 9,2 gam một hợp chất hữu cơ Y bằng một lượng vừa đủ khí oxi, thu được 8,96 lít khí CO2 và 10,8 gam nước. Tỉ khối của Y so với heli là 11,5. Các khí đo ở đktc.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

mH=25%.16=4(g) -> nH=4/1=4(mol)
Hợp chất hữu cơ luôn có C -> Nguyên tố còn lại C -> mC=16-4=12(g)
=>nC=12/12=1(mol)
Vì: nC:nH=1:4 -> A: CH4 (Metan)

%O = 100- (60 + 13,33) = 26,67
Gọi công thức hóa học của A là C x H y O z
Ta có tỷ lệ: x : y : z = 60/12 : 13,33/1 : 26,67/16 = 5 : 13,33 : 1,67 = 3 : 8 : 1
Công thức của hợp chất là C 3 H 8 O n
Ta có: (12.3+1.8+16)n=60
⇔ 60n= 60 → n=1
Vậy công thức phân tử của C x H y O z là C 3 H 8 O

Bảo toàn C: \(n_C=n_{CO_2}=\dfrac{13,2}{44}=0,3\left(mol\right)\)
Bảo toàn H: \(n_H=2n_{H_2O}=2.\dfrac{5,4}{18}=0,6\left(mol\right)\)
\(n_O=\dfrac{4,2-\left(0,3.12+0,6\right)}{16}=0\left(mol\right)\)
`->` A gồm C và H
Đặt CTTQ A: CxHy
\(x:y=0,3:0,6=1:2\)
CT có dạng: \(\left(CH_2\right)_n< 30\)
\(\Leftrightarrow n< 2,14\)
`@` Chỉ có `n=2` thỏa mãn
`->` CTPT A: \(C_2H_4\)
CTCT: \(CH_2=CH_2\) `->` A làm mất màu dd Brom
\(CH_2=CH_2+Br_{2\left(dd\right)}\rightarrow CH_2Br-CH_2Br\)

gọi công thức phân tử của hợp chất hữu cơ A là CXHYOZ
Ta có : %O =100-(60+ 13.33)=26.63%
Ta có ;
\(\frac{12x}{60}\)=\(\frac{y}{13.33}\)=\(\frac{16z}{26.67}\)=\(\frac{60}{100}\)= 0.6
do đó : x=\(\frac{60.0,6}{12}\)=3
y=0,6.13,33=8
z=\(\frac{26,67.0,6}{16}\)=1
vậy công thức phân tử của A là C3H8O.

a, có nCO2=11/44=0,25 mol
có nC=nCO2=0,25mol=>mC=12.0,25=3(g)
có nH2O=6,75/18=0,375mol
có nH=2nH2O=2.0,375=0,75mol=>mH=0,75(g)
=>mH+mC=0,75+3=3,75=mA
=> A gồm nguyên tố C và H
b, gọi CTPT A là CxHy
có x/y=nC/nH=0,25/0,75=1/3
=> công thức thực nghiệm (CH3)n<=>CnH3n
có MA=30 gam/mol<=>12n+3n=30<=>n=2
vậy CTPT của A là C2H6
c;PTHH: CO2+2NaOH->Na2CO3+H2O
=> nNa2CO3=nCO2=0,25mol=>mNa2CO3=0,25.106=26,5 gam

Đáp án:
C20H36O4C20H36O4
Giải thích các bước giải:
a) Gọi A là CxHyOzCxHyOz
%mO=100−70,97−10,15=18,88%%mO=100−70,97−10,15=18,88%
x:y:z=%mC/12:%mH/1:%mO/16=70,97/12:10,15/1:18,88/16=5,914:10,15:1,18=5:9:1x:y:z=%mC/12:%mH/1:%mO/16=70,9712:10,151:18,8816=5,914:10,15:1,18=5:9:1
⇒ CTĐGN của A: C5H9OC5H9O
CTPT của A: (C5H9O)n(C5H9O)n
⇒MA=85n=340⇒n=4⇒MA=85n=340⇒n=4
CTPT của A là C20H36O4C20H36O4
b) Gọi A là CxHyOzCxHyOz
mC=12x=MA.70,97%=340.70,97%=240⇒x=24012=20mH=y=MA.10,15%=340.70,97%=36mO=340−12x−y=64⇒z=6416=4mC=12x=MA.70,97%=340.70,97%=240⇒x=24012=20mH=y=MA.10,15%=340.70,97%=36mO=340−12x−y=64⇒z=6416=4
CTPT của A là C20H36O4

Đáp án A
Thành phần % khối lượng của O = 100 – (52,17 + 13,04) = 34,79%
nC : nH : nO = 52,17/12 : 13,04 : 34,79/16 = 4,35 : 13,04 : 2,17 = 2: 6: 1
=> Công thức đơn giản nhất là C 2 H 6 O 2 .
M = (2x12+6+16)n = 46 => n =1
Vậy công thức phân tử: C 2 H 6 O 2


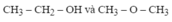
Bài 1 :
a)
Gọi hợp chất A là CxHy
\(\%_H=100\%-92,31\%=7,69\%\)
\(x=\frac{78.92,31}{12.100}=6\)
\(y=\frac{78.7,69}{1.100}=6\)
Vậy A là C6H6
b) Gọi B là CxHyClz
\(\%_C=100\%-70,3\%-5,94\%=23,76\%\)
\(x=\frac{50,5.23,76}{12.100}=1\)
\(y=\frac{50,5.5,94}{1.100}=3\)
\(z=y=\frac{50,5.70,3}{35,5.100}=1\)
Vậy B là CH3Cl
Bài 2 :
Vì sau phản ứng thu đc CO2 và H2O nên hợp chất hữu cơ đó gồm các nguyên tố C;H, có thể có O
Gọi chất cần tìm là CxHyOz
\(PTHH:C_xH_yO_z+\left(x+\frac{y}{4}-\frac{x}{2}\right)\rightarrow xCO_2+\frac{y}{2}H_2O\)
\(n_{CO2}=\frac{8,96}{22,4}=0,4\left(mol\right)\)
\(n_{H2O}=\frac{10,08}{22,4}=0,5\left(mol\right)\)
\(M_Y=11,5.4=46\left(\frac{g}{mol}\right)\)
\(n_{CxHyOz}=\frac{9,2}{46}=0,2\left(mol\right)\)
Ta có:
\(n_Y=\frac{1}{x}n_{CO2}\) hay \(0,2=\frac{0,4}{x}\Rightarrow x=2\)
\(n_Y=\frac{2}{y}n_{H2O}\) hay \(0,2=\frac{1}{y}\Rightarrow y=5\)
\(M_Y=46=12.2+5+16z\Rightarrow z=1\)
Vậy Y là C2H5O