Hỗn hợp A gồm Al2O3 và Fe2O3. Dẫn khí CO qua 10,55 gam A và nung nóng thu được hỗn hợp rắn B gồm 5 chất và hỗn hợp khí D. Dẫn D qua dung dịch Ca(OH)2 dư có 2,5 gam kết tủa. Đem hỗn hợp B tác dụng vừa đủ với 0,5 lít dung dịch H2SO4 loãng 0,5 M thì có 1,12 lít khí thoát ra (đktc). Viết pt hóa học xảy ra và tính % khối lượng mỗi chất trong hỗn hợp A.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : B
nCO2 = nO pứ =nCaCO3 = 0,15 mol
nH2SO4 = 0,35 mol ; nH2 = 0,05 mol
Bảo toàn H : nH2SO4 = nH2 + nH2O => nH2O = 0,3 mol = nO (oxit)
=> nO bđ =0,3 + 0,15 = 0,45 mol
=> 3nAl2O3 + 3nFe2O3 = 0,45 mol
Và 102nAl2O3 + 160nFe2O3 = 21,1g
=> nAl2O3 = 0,05 mol ; nFe2O3 = 0,1 mol
=> %mAl2O3 = 24,17%

Chọn đáp án D
nCO phản ứng = nCO2 sinh ra = nO bị lấy ra
Vậy m = 0,1.100 = 10

Đặt a, b, c là số mol Al203, CuO , FeO mA = 102a + 80b + 72c = 20,3 m rắn = 102a + 64b + 56c = 17,1 nHCl = 6a + 2b + 2c = 0,7 -> a = 0,05 ; b = c = 0,1 Trong B chứa nCO2 = b + c = 0,2 nCaCO3 = 0,1 -> nCa(HCO3)2 = 0,05 -> nCa(OH)2 = 0,15 -> Vdd =105 ml

Trong trường hợp này, X đã “bão hòa”, không thể cho e được nữa, nhưng nó đã được CO lấy đi một lượng O để phá vỡ trạng thái này. CO + [O] →CO2
Và thế là X trở thành Y, lại có thể cho e với N+5 tạo thành NO, NO2.
Theo lý thuyết, nếu HNO3 lại đưa Y lên trạng thái bão hòa thì số mol e mà N+5 nhận được là 0,24 x 2 = 0,48 mol
Nhưng trên thực tế, con số này là 0,11 x 3 + 0,07 x 1= 0,40 mol
Sở dĩ điều này xảy ra là do có một lượng Fe chỉ tồn tại ở số oxi hóa +2
→ nFe2+ = 0,48 – 0,40 =0,08 → mFe(NO3)2 = 14,4 gam
Chọn đáp án C

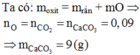



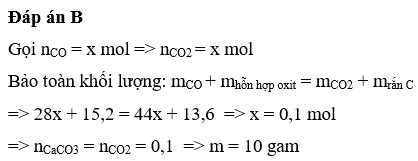
Hệ ra nghiệm âm