Tính nồng độ mol của dung dịch thu được khi Trộn 150 ml dung dịch HCl 1,5M với 100 ml dung dịch HCL 2M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(m_{dd_{HCl\left(10\%\right)}}=150\cdot1.206=180.9\left(g\right)\)
\(n_{HCl}=\dfrac{180.9\cdot10\%}{36.5}\approx0.5\left(mol\right)\)
\(n_{HCl\left(2M\right)}=0.25\cdot2=0.5\left(mol\right)\)
\(n_{HCl}=0.5+0.5=1\left(mol\right)\)
\(V_{dd_{HCl}}=150+250=400\left(ml\right)=0.4\left(l\right)\)
\(C_{M_{HCl}}=\dfrac{1}{0.4}=2.5\left(M\right)\)

\(n_{Na_2CO_3}=0,2\left(mol\right);n_{HCl}=0,3\left(mol\right)\\ Na_2CO_3+HCl\rightarrow NaHCO_3+NaCl\\ LTL:\dfrac{0,2}{1}< \dfrac{0,3}{1}\Rightarrow HCldư\\ NaHCO_3+HCl\rightarrow NaCl+H_2O+CO_2\\ LTL:\dfrac{0,2}{1}>\dfrac{0,1}{1}\Rightarrow NaHCO_3dư\\\Rightarrow n_{CO_2}=n_{HCl}=0,1\left(mol\right)\\ \Rightarrow V_{CO_2}=0,1.22,4=2,24\left(l\right)\\ DungdịchA:NaHCO_3:0,1\left(mol\right);NaCl:0,3\left(mol\right)\\ \Rightarrow CM_{NaCl}=\dfrac{0,3}{0,3}=1M;CM_{NaHCO_3}=\dfrac{0,1}{0,3}=0,33M\)

Đáp án D
Dd axit ban đầu có [H+] =0,1 M → nH+=0,1.0,1 =0,01 mol
Dd sau phản ứng có pH = 12 → dư bazo và có pOH =14-12=2 → [OH-] =0,01M→ nOH = 0,002 mol
PTHH: H+ + OH- → H2O
Ta có nNaOH = nH+ + nOH dư = 0,01 + 0,002 = 0,012 mol → a = 0,12M

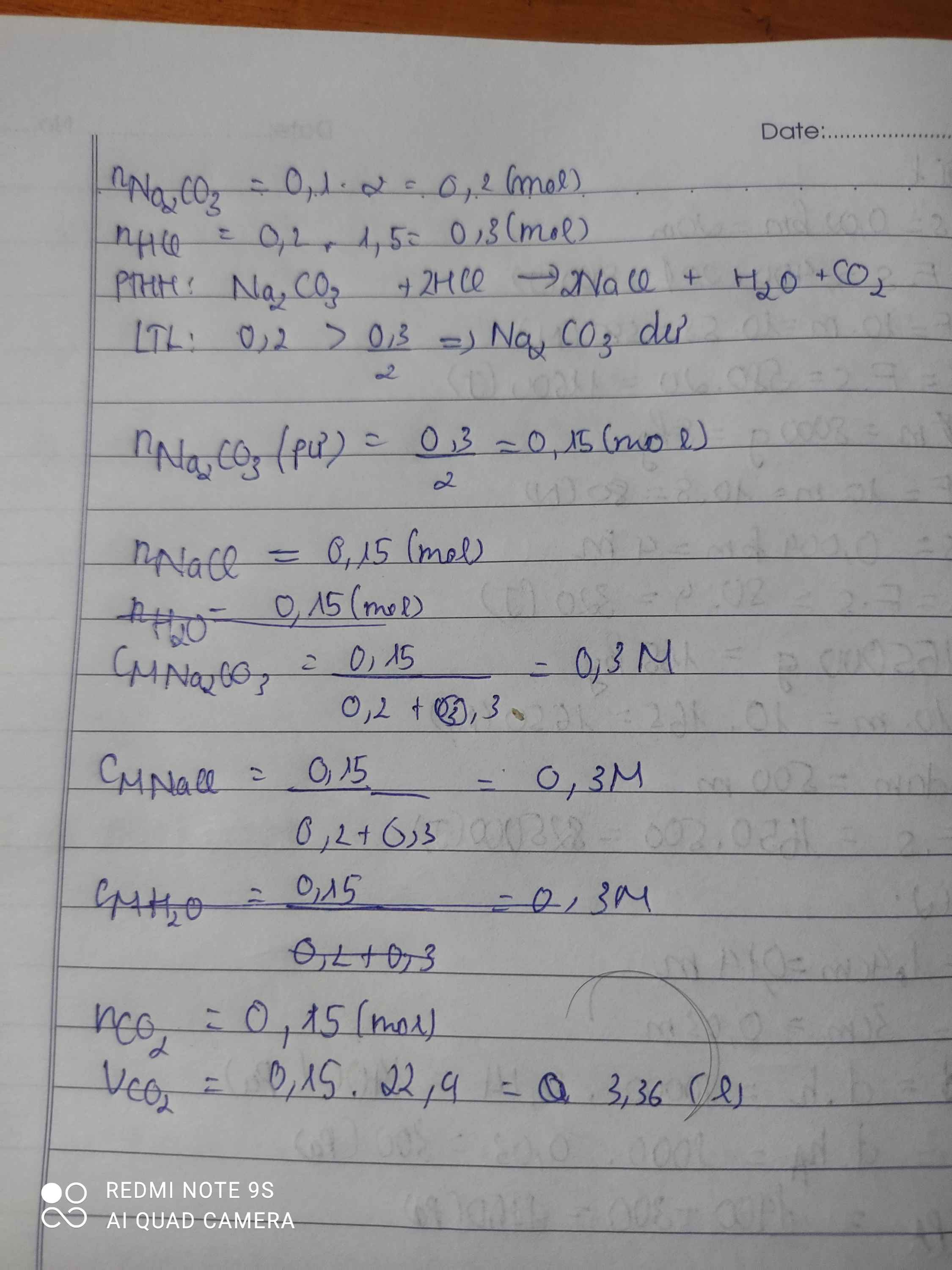
nHCl 1,5M= 0,15.1,5=0,225(mol)
nHCl 2M= 0,1.2=0,2(mol)
CM HCl = \(\frac{0,225+0,2}{0,15+0,1}\)=1,21M