4) Chia 35g hỗn hợp X chứa Fe, Cu, Al thành 2 phần bằng nhau:
Phần I: cho tác dụng hoàn toàn dung dịch HCl dư thu 6,72 lít khí (đktc)
pPhan62 II: cho tác dụng vừa đủ 10,64 lít khí clo (đktc)
Tính % khối lượng từng chất trong X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phần 1
2Al +6 HCl ----> 2AlCl3 + 3H2 (1)
Fe + 2HCl ----> FeCl2 + H2 (2)
Cu ko pư với dd HCl
Phần 2
2Al + 2NaOH + 2H20 ---> 2NaAlO2 + 3H2 (3)
Fe và Cu ko pư với dd NaOH
Theo pt(3) n Al = \(\frac{2}{3}\).n H2=\(\frac{2}{3}\). \(\frac{3,36}{22,4}\)=0,1 (mol)
%m Al= \(\frac{0,1.27}{20}\).100%= 13,5%
Theo pt(1)(2) tổng n H2=\(\frac{3}{2}\). nAl + n Fe=\(\frac{5,6}{22,4}\)
==> 0,15 + n Fe = 0,25 ==> n Fe = 0,1 (mol)
%m Fe= \(\frac{0,1.56}{20}\).100%= 28%
%m Cu=100% - 13,5% - 28% =58,5%
tại sao % Al lại đem chia 20 vậy 0,1 mol là ở 1 phần thôi là chia 10 chứ .% Fe cũng thế vậy
==> tổng mAl + mFe trong 1 phần = 0,1.27 + 0,1.56=8,3
%Cu =100% - \(\dfrac{8,3}{10}\).100=17%

Chọn B
Phần I. Cho X tác dụng với HNO 3 đặc, nguội chỉ có Cu phản ứng.
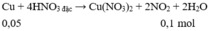
Phần II. Cho X tác dụng với H 2 SO 4 loãng, dư chỉ có Fe phản ứng
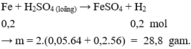

Gọi số mol của Cu, Fe, Al trong 23,8 gam hhX lần lượt là x, y, z mol
→ mX = 64x + 56y + 27z = 23,8 (1)
\(n_{Cl_2}\) = x + 1,5y + 1,5z = 0,65 (2)
0,25 mol X + HCl → 0,2 mol H2 nên 0,2.(x + y + z) = 0,25.(y + 1,5z) (3)
Từ (1), (2), (3) => x = 0,2 mol; y = 0,1 mol; z = 0,2 mol
\(\%_{Cu} = \dfrac{0,2. 64}{23,8} \approx 53,78\%\)
\(\%_{Fe} = \dfrac{0,1 .56}{23,8} \approx 23,53\%\)
%Al ≈ 22,69%

\(n_{Cu} = a ; n_{Al} = b ; n_{Fe} = c(mol)\\ \Rightarrow 64a + 27b + 56c = 28,6(1)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = 1,5b + c = \dfrac{13,44}{22,4} = 0,6(2)\\ \text{Mặt khác} : n_{O_2} = \dfrac{8,96}{22,4} = 0,4(mol)\\ 2Cu + O_2 \xrightarrow{t^o} 2CuO\\ 4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3\\ 4Fe + 3O_2 \xrightarrow{t^o} 2Fe_2O_3\\ \)
Ta có :
\(\dfrac{n_X}{n_{O_2}}=\dfrac{a+b+c}{0,5a +0,75b + 0,75c} = \dfrac{0,6}{0,4}(3)\\ (1)(2)(3)\Rightarrow a = \dfrac{317}{1460} ; b = \dfrac{121}{365}; c = \dfrac{15}{146}\\ \%m_{Cu} = \dfrac{\dfrac{317}{1460}.64}{28,6}.100\% = 48,59\%\\ \%m_{Al} = \dfrac{\dfrac{121}{365}.27}{28,6}.100\% = 31,3\%\\ \%m_{Fe} = 100\% - 41,59\% - 31,3\% = 27,11\%\)
nFe(I)= nFe(II)=nFe/2=x (mol) ;
nCu(I)=nCu(II)=nCu/2=y (mol);
nAl(I)=nAl(II)=nAl/2=z(mol)
Phần II:
2 Fe + 3 Cl2-to-> 2 FeCl3
x____1,5x_______x(mol)
Cu + Cl2 -to-> CuCl2
y_______y____y(mol)
2 Al + 3 Cl2 -to-> 2 AlCl3
z______1,5z____z(mol)
nCl2= 10,64/22,4=0,475(mol)
=> 1,5x+y+z=0,475 (a)
Mặt khác: mFe(II) + mCu(II)+ mAl(II)= 35/2= 17,5(g)
<=> 56x+64y+27z=17,5 (b)
Phần I:
Fe + 2 HCl -> FeCl2 + H2
x____2x_____x_____x(mol)
2 Al + 6 HCl -> 2 AlCl3 + 3 H2
z____3z________z______1,5z(mol)
nH2= 6,72/22,4=0,3
=> x+1,5z= 0,3 (c)
Từ (a),(b),(c)
\(\left\{{}\begin{matrix}1,5x+y+1,5z=0,475\\56x+64y+27z=17,5\\x+1,5z=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,15\\y=0,1\\z=0,1\end{matrix}\right.\)
Vì 2 phần bằng nhau nên % khối lượng mỗi kim loại từng phần bằng % khối lượng mỗi kim loại cả hỗn hợp:
%mFe=(0,15.56)/17,5 .100=48%
%mCu= (0,1.64)/17,5 .100=36,371%
=> %mAl= 100% - (48%+36,371%)= 15,629%