Câu 1: viết các phương trình phản ứng xảy ra cho các sơ đồ saua,HCl→Cl2→FeCl3→NaCl→HCl→CuCl2→AgClb,KMnO4→Cl2→HCl→FeCl3→AgCl→Cl2→Br2→I2→ZnI2→Zn(OH)2c,MnO2→Cl2→KClO3→KCl→HCl→Cl2→Clorua vôiCâu 2: Nhận biết các dạng dung dịch mất nhãn sau bằng phương pháp hóa học :NaCl,NaBr,NaI,HCl,H2SO4,NaOH.Câu 3: Cho 31,6 g KMnO4 tác dụng với dung dịch HCl dư sẽ thu được bao nhiêu lít Cl2(ở đktc) nếu H của phản ứng là 75 %Câu 4: Cho 8,3 gam hỗn hợp...
Đọc tiếp
Câu 1: viết các phương trình phản ứng xảy ra cho các sơ đồ sau
a,HCl→Cl2→FeCl3→NaCl→HCl→CuCl2→AgCl
b,KMnO4→Cl2→HCl→FeCl3→AgCl→Cl2→Br2→I2→ZnI2→Zn(OH)2
c,MnO2→Cl2→KClO3→KCl→HCl→Cl2→Clorua vôi
Câu 2: Nhận biết các dạng dung dịch mất nhãn sau bằng phương pháp hóa học :NaCl,NaBr,NaI,HCl,H2SO4,NaOH.
Câu 3: Cho 31,6 g KMnO4 tác dụng với dung dịch HCl dư sẽ thu được bao nhiêu lít Cl2(ở đktc) nếu H của phản ứng là 75 %
Câu 4: Cho 8,3 gam hỗn hợp Al,Fe,Mg tác dụng hết với dung dịch HCl vừa đủ .Sau phản ứng khối lượng dung dịch HCl tăng thêm 7,8 gam . Tính khối lượng muối thu được.
Câu 5: Hỗn hợp khí X gồm o6zon và oxi có tỉ khối đối với hidro bằng 17,2. Tính phần trăm theo thể tích mỗi khí trong hỗn hợp X.
Câu 6:Cho 9 gam hỗn hợp gồm Al và Cu tác dụng với lượng dư dung dịch HCl nồng độ 20% . Sau phản ứng thu được 1,344 lít khí (ở đktc).
a, Tính % về khối lượng các kim loại trong hỗn hợp ban đầu
b,Tính khối lượng dung dịch HCl đã dùng . Biết rằng lượng dung dịch HCl đã dùng được lấy dư 10% so với lượng cần thiết cho phản ứng.

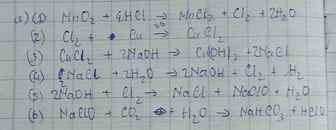


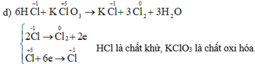
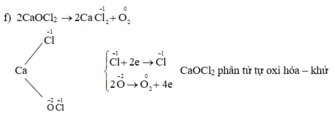

 3)
3)
1.
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
\(H_2+Cl_2\underrightarrow{^{as}}2HCl\)
\(NaOH+HCl\rightarrow NaCl+H_2O\)
\(2NaCl\underrightarrow{^{đpnc}}2Na+Cl_2\)
\(4Cl_2+H_2S+4H_2O\rightarrow8HCl+H_2SO_4\)
\(NaCl+H_2SO_4\rightarrow NaHSO_4+HCl\)
2.
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(6KOH+3Cl_2\rightarrow5KCl+KClO_3+3H_2O\)
\(KClO_3+6HCl\rightarrow KCl+3Cl_2+3H_2O\)
\(Fe+\frac{3}{2}Cl_2\underrightarrow{^{to}}FeCl_3\)
\(FeCl_3+3KOH\rightarrow Fe\left(OH\right)_3+3KCl\)
\(2KCl+2H_2O\underrightarrow{^{đpmn}}2KOH+Cl_2+H_2\)
3.
\(BaCl_2\underrightarrow{^{đpnc}}Ba+Cl_2\)
\(Cl_2+H_2\underrightarrow{^{as}}2HCl\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2FeCl_2+3Cl_2\rightarrow2FeCl_3\)
\(3Ba\left(OH\right)_2+2FeCl_3\rightarrow3BaCl_2+2Fe\left(OH\right)_3\)
\(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
4.
\(C_2H_2+Cl_2\rightarrow2C+2HCl\)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(CuCl_2+2KOH\rightarrow Cu\left(OH\right)_2+2KCl\)
\(2KCl+2H_2O\underrightarrow{^{đpmn}}2KOH+H_2+Cl_2\)
\(3Cl_2+6KOH\rightarrow5KCl+KClO_3+3H_2O\)
\(KClO_3+6HCl\rightarrow KCl+3Cl_2+3H_2O\)
5.
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
\(2Fe+3Cl_2\rightarrow2FeCl_3\)
\(FeCl_3+3NaOH\rightarrow Fe\left(OH\right)_3+3NaCl\)
\(NaCl+H_2SO_4\rightarrow NaHSO_4+HCl\)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(CuCl_2+AgNO_3\rightarrow Cu\left(NO_3\right)_2+2AgCl\)
6.
\(NaCl+H_2SO_4\rightarrow NaHSO_4+HCl\)
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+H_2O\)
\(6KOH+3Cl_2\rightarrow5KCl+KClO_3+3H_2O\)
\(KClO_3+6HCl\rightarrow KCl+3Cl_2+3H_2O\)
\(2KCl\underrightarrow{^{đpnc}}2K+Cl_2\)
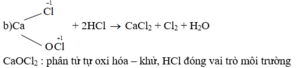
\(Cl_2+Ca\left(OH\right)_2\rightarrow CaOCl_2+H_2O\)
1. MnO2 +4HCl→ Cl2+MnCl2+4H2O
Cl2+2H2→ 2HCl
HCl+Na2O→ NaCl+H2O
2NaCl → Cl2+2Na
2Cl2+2H2O+CO2→ H2SO4 +4HCl
H2SO4+BaCl2→ 2HCl+BaSO4
2. 2KMnO4 +16HCl→ 5Cl2+8H2O+2KCl+2MnCl2
2Cl2+6KOH→ KClO3 +5KCl+3H2O
KClO3+6HCl→ 3Cl2+KCl+3H2O
3Cl2+2Fe→2 FeCl3
FeCl3+3KOH→ 3KCl +Fe(OH)3
2KCl+2H2O→ KOH+Cl2+2H2O
3. BaCl2 → Cl2+Ba
Cl2+2H2→ 2HCl
2HCl+Fe→ FeCl2+H2
2FeCl2+Cl2→ 2FeCl3
2FeCl3+3Ba(OH)2→ 3BaCl2+2Fe(OH)3
BaCl2+H2SO4→ 2HCl+BaSO4
Mỏi tay rồi :((