3. Cho 8,3 gam hỗn hợp hai kim loại Fe, Al tác dụng vs dd HCl dư thu được 5,6 lít H2 (đktc) . Tính thành phần % khối lượng mỗi kim loại trong hỗn hợp . 4. Cho 7 gam hỗn hợp hai kim loại Mg , Na tác dụng vs dd HCl dư thu được 8,96 lít H2 ( đktc) . Tính thành phần % khối lượng mỗi kim loại trong hỗn hợp.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1)\(Mg+HCl\rightarrow MgCl_2+H_2\)
x____________________x
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
y ____________________1,5y
Giải hệ phương trình :
\(\left\{{}\begin{matrix}x+\frac{3}{2y}=0,5\\24x+27y=10,2\end{matrix}\right.\rightarrow x=y=0,2\)
\(\%_{Mg}=\frac{0,2.24}{10,2}.100\%=47,1\%\)
\(\rightarrow\%m_{Al}=100\%-47,1\%=52,9\%\)

Gọi số mol Al và Fe lần lượt là a;b
$\Rightarrow 27a+56b=8,3$
Bảo toàn e ta có: $3a+3b=0,6$
Giải hệ ta được $a=b=0,1$
$\Rightarrow m_{Al}=2,7(g);m_{Fe}=5,6(g)$
\(n_{Al}=a\left(mol\right),n_{Fe}=b\left(mol\right)\)
\(m=27a+56b=8.3\left(g\right)\left(1\right)\)
\(n_{SO_2}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(BTe:\)
\(3a+3b=0.3\cdot2=0.6\left(2\right)\)
\(\left(1\right),\left(2\right):a=b=0.1\)
\(m_{Al}=0.1\cdot27=2.7\left(g\right)\)
\(m_{Fe}=5.6\left(g\right)\)

Phần 1 :
$m_{Cu} = 0,4(gam)$
Gọi $n_{Fe} = a ; n_{Al} = b \Rightarrow 56a + 27b + 0,4 = 1,5 : 2 = 0,75(1)$
$Fe + 2HCl \to FeCl_2 + H_2$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$n_{H_2} = a + 1,5b = \dfrac{896}{1000.22,4} = 0,04(2)$
Từ (1)(2) suy ra a = -0,025 < 0$
$\to$ Sai đề

a/ PTHH: Mg + 2HCl ==> MgCl2 + H2
Fe + 2HCl ===> FeCl2 + H2
b/ nH2 = 11,2 / 22,4 = 0,5 mol
Đặt số mol của Mg, Fe lần lượt là x, y
Theo đề ra, ta có hệ phương trình sau:
\(\begin{cases}24x+56y=23,2\\x+y=0,5\end{cases}\)=> \(\begin{cases}x=0,15\\y=0,35\end{cases}\)
=> mMg = 0,15 x 24 = 3,6 gam
mFe = 0,35 x 56 = 19,6 gam
Mg + 2 HCl => MgCl2 + H2
y y
Fe + 2HCl => FeCl2 + H2
x x
ta có mol H2 =\(\frac{11,2}{22,4}\) = 0,5 mol
ta có mFe + mMg = 23,2 <=> 56x + 24y = 23,2 (1)
x + y = 0,5 (2)
Từ (1) và (2) => x=0,35 , y = 0,15
=> mFe = 0,35 x 56 = 19,6 g , mMg = 23,2 -19,6 = 3,6 g

\(n_{H_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Ag}=y\left(mol\right)\end{matrix}\right.\Rightarrow27x+108y=4,2\left(1\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,1 0,05 0,15
\(\Rightarrow m_{Al}=0,1\cdot27=2,7g\)
\(\Rightarrow m_{Ag}=4,2-2,7=1,5g\)
a)\(\%m_{Al}=\dfrac{2,7}{4,2}\cdot100\%=64,28\%\)
\(\%m_{Ag}=100\%-64,28\%=35,72\%\)
b)\(m_{muối}=0,05\cdot342=17,1g\)

Đáp án A
Gọi số mol các kim loại là Al: a mol; Fe: b mol.
Ta có:
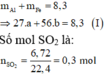
Sơ đồ phản ứng:
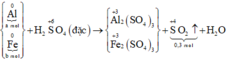
Các quá trình nhường, nhận electron:

3. PTHH: (1) Fe + 2 HCl -> FeCl2 + H2
x______________2x______x___x(mol)
(2) 2 Al + 6 HCl -> 2 AlCl3 + 3 H2
y__________3y_____y___________1,5y(mol)
nH2= 5,6/22,4 =0,25 (mol)
Ta có: \(\left\{{}\begin{matrix}56x+27y=8,3\\x+1,5y=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
=> mFe= 0,1.56= 5,6(g) => %mFe=\(\frac{5,6}{8,3}.100\approx67,47\%\\ =>\%mAl\approx32,53\%\)
cho t hỏi sao t tính số mol al vs fe theo số mol h2 thì ko ra như kqua bạn z. gthik hộ t vs