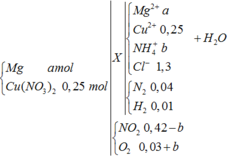
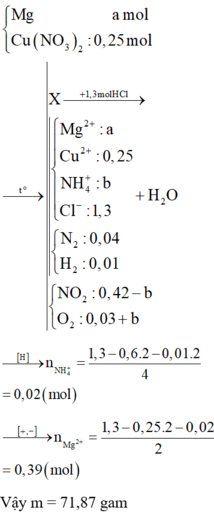
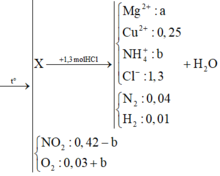
Nung nóng hỗn hợp chất rắn A gồm a mol Mg và 0,25 mol Cu(NO3)2, sau một thời gian thu được chất rắn X và 0,45 mol hỗn hợp khí NO2 và O2. X tan hoàn toàn trong dung dịch chứa vừa đủ 1,3 mol HCl, thu được dung dịch Y chứa m gam hỗn hợp muối clorua và thoát ra 0,05 mol hỗn hợp khí Z gồm N2 và H2. Tỉ khối của Z so với H2 là 11,4. Tìm m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
BT O : nH2O = 0,25.6 – 0,45.2 = 0,6 mol
BT H : nNH4 = ¼ (1,3 – 0,6.2 – 0,01.2) = 0,02 mol
BT ĐT : nMg = ½ (1,3 – 0,25.2 – 0,02) = 0,39 mol
Vậy m = 71,87 gam

Chọn đáp án C
Ta có ngay :  .Chú ý : Có H2 bay ra
.Chú ý : Có H2 bay ra
nghĩa là dung dịch không còn ![]()
Chúng ta hãy tư duy theo kiểu chặn đầu
với câu hỏi đơn giản nhưng quan trọng.
Clo trong HCl đi đâu? Rất nhanh có
 .
.
![]()
Tiếp tục, một câu hỏi nữa .0,25.3.2=1,5
mol O ban đầu đã phân bổ đi những đâu?
Nó chỉ đi vào H2O và bay lên trời
trong hỗn hợp khí (0,45 mol).
Như vậy ![]()
![]()

Đáp án D
Hỗn hợp gồm: Mg ( a mol) ; Cu(NO3)2 ( 0,25 mol)
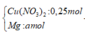
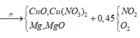
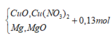
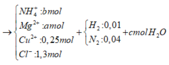
Vì H2 sinh ra nên không còn NO3− trong muối
Bảo toàn điện tích trong dung dịch → 2a + b + 0,25 .2 = 1,3 → 2a + b = 0,8 (1)
Bảo toàn mol H: 1,3 = 4b + 0,01 . 2 + 2c → 4b + 2c = 1,28 (2)
Bảo toàn O:
→ a = 0,39 ; b = 0,02 , c = 0,6
Vậymmuoi = 24.0,39 + 18.0,02 + 64.0,25 + 35,5.1,3 = 71,87 g
→ a = 0,39 ; b = 0,02 , c = 0,6
Vậy mmuoi = 24.0,39 + 18.0,02 + 64.0,25 + 35,5.1,3 = 71,87 gam

Chọn đáp án C
Đặt nN2 = x; nH2 = y ⇒ nA = x + y = 0,05 mol; mA = 28x + 2y = 0,05 × 11,4 × 2
Giải hệ có: x = 0,04 mol; y = 0,01 mol || nO/khí = 2.∑n(NO2, O2) . Bảo toàn nguyên tố Oxi:
nO/H2O = 0,25 × 6 - 0,45 × 2 = 0,6 mol. Bảo toàn nguyên tố Hidro: nNH4+ = 0,02 mol.
nCl–/Z = nHCl = 1,3 mol. Bảo toàn điện tích: nMg2+ = (1,3 - 0,25 × 2 - 0,02)/2 = 0,39 mol.
⇒ m = 0,39 × 24 + 0,25 × 64 + 0,02 × 18 + 1,3 × 35,5 = 71,87(g) ⇒ chọn C.

Đặt nN2 = x; nH2 = y ⇒ nA = x + y = 0,05 mol;
mA = 28x + 2y = 0,05 × 11,4 × 2
Giải hệ có: x = 0,04 mol; y = 0,01 mol
nO/khí = 2.∑n(NO2, O2) . Bảo toàn nguyên tố Oxi:
nO/H2O = 0,25 × 6 - 0,45 × 2 = 0,6 mol.
Bảo toàn nguyên tố Hidro: nNH4+ = 0,02 mol.
nCl–/Z = nHCl = 1,3 mol.
Bảo toàn điện tích:
nMg2+ = (1,3 - 0,25 × 2 - 0,02)/2 = 0,39 mol.
⇒ m = 0,39 × 24 + 0,25 × 64 + 0,02 × 18 + 1,3 × 35,5 = 71,87(g)
Đáp án C
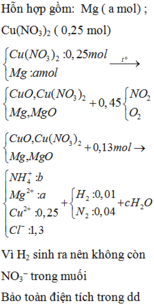
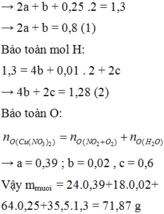
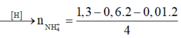
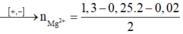



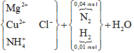

2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑ (1)
2Mg + O2 → 2MgO (2)
Hỗn hợp rắn X gồm CuO, MgO, Mg dư và Cu(NO3)2
Hỗn hợp X tác dụng với 1,3 mol HCl sinh ra hh Z
Vì sản phẩm khử có H2 nên NO3- pư hết
Áp dụng quy tắc đường chéo ta có:
\(\frac{nN2}{nH2}=\frac{20,8}{5,2}=\frac{4}{1}=\frac{0,04}{0,01}\)
Bảo toàn nguyên tố O có:
nO(X) = 6nCu(NO3)2 - 2nNO2+O2 = 6.0,25 - 2.0,45 = 0,6 (mol)
Xét phản ứng trao đổi giữa H+ và O(trong X)
2H+ + O-2 → H2O
0,6 → 0,6 (mol)
=> nH2O = nO(X) = 0,6 (mol)
BTNT "H": nHCl = 4nNH4+ + 2nH2 + 2nH2O
=> 1,3 = 4nNH4+ + 2.0,01 + 2.0,6
=> nNH4+ = 0,02 (mol)
Dung dịch muối thu được gồm: NH4+: 0,02 (mol); Cu+2: 0,25 (mol); Cl-: 1,3 (mol): Mg2+: a (mol)
Bảo toàn điện tích ta có: nNH4+ + 2nCu2+ + 2nMg+2 = nCl-
=> 0,02 + 2.0,25 + 2a = 1,3
=> a = 0,39 (mol)
=> m muối = 0,02.18 + 0,25.64 + 1,3.35,5 + 0,39.24 = 71,87 (g)