Dung dịch X chứa Bacl2 0.05M và HCl 0.10M Bỏ qua sự điện li của nước a, viết phương trình điện li của các chất trong X b, tính. Nồng độ mol/l của các ion trong X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)\(BaCl_2\rightarrow Ba^{2+}+2Cl^-\)
0,05 0,05 0,1
\(\left[Ba^{2+}\right]=0,05M\)
\(\left[Cl^-\right]=0,1M\)
b)\(HCl\rightarrow H^++Cl^-\)
0,1 0,1 0,1
\(\left[H^+\right]=0,1M\)
\(\left[Cl^-\right]=0,1M\)

Đáp án C
Ba(HCO3)2 + NaHSO4® BaSO4 ↓+ NaHCO3 + CO2 ↑+ H2O
Vậy sau phản ứng, trong dung dịch còn lại các ion Na+ và HCO3-.

Không mất tính tổng quát, ta đặt:
![]()
Vì HCl là chất điện li mạnh nên ta có phương trình điện li như sau:
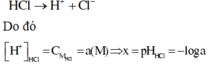
Vì CH3COOH là chất điện li yếu nên ta có phương trình điện li như sau
Xét cân bằng điện li: CH3COOH ⇌ CH3COO- + H+
Nồng độ ban đầu: aM 0
Nồng độ phân li: 0,01a M → 0,01a M
Nồng độ cân bằng: 0,99a M 0,01a M
Ta có
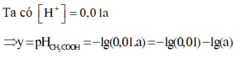
![]()
Đáp án A.

Đáp án C. Vì chỉ rõ các ion nào đã tác dụng với nhau làm cho phản ứng xảy ra.
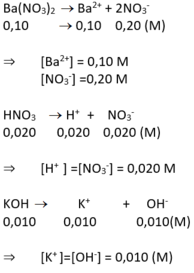
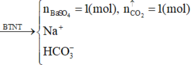
1) \(BaCl_2\) 0,05M \(BaCl_2\rightarrow Ba^{2+}+2Cl^-\)
\(\left[Ba^{2+}\right]=0,05M\)
\(\left[Cl^-\right]=0,1M\)
2) \(HCl\) 0,1M \(HCl\rightarrow H^++Cl^-\)
\(\left[H^+\right]=0,1M\)
\(\left[Cl^-\right]=0,1M\)