Đồng trong tự nhiên có 2 đồng vị 6529Cu, 6329Cu với tỷ số 63Cu/ 65Cu = 105/ 245.Tính nguyên tử khối của Cu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi % 63Cu là a% => % 65Cu = (100-a ) %
Theo bài ra : \(\frac{a}{100-a}=\frac{105}{245}\) => a = 30%
\(M_{Cu}=\frac{63.30+65.70}{100}=64,4\) ( u)
nguyên tử khối trung bình của Cu
Mtb(Cu) = 105.63+245.65 =64,4 (g/mol)
105 + 245

nguyên tử khối trung bình của Cu
Mtb(Cu) = 105.63+245.65 =64,4 (g/mol)
105 + 245

Đáp án A
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
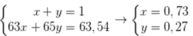
Phần trăm khối lượng của 63Cu trong CuSO4 là
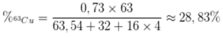

vì tỷ lệ số nguyên tử giửa 2 đồng vị là \(37:13\)
\(\Rightarrow\) nguyên tử khối trung bình của \(Cu\) là \(\dfrac{63.37+65.13}{50}=63,52\)
vậy nguyên tử khối trung bình của \(Cu\) là \(63,52\)

Đáp án D
• Giả sử % của 63Cu, 65Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
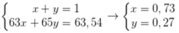
→ Phần trăm của 63Cu trong CuCl2 là
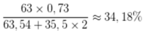

Đáp án B
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
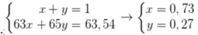
Phần trăm khối lượng của 63Cu trong Cu2O là
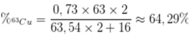

Đồng vị \(^{65}Cu\) chiếm 27% về số nguyên tử.
\(\Rightarrow\)Đồng vị \(^{63}Cu\) chiếm 73% về số nguyên tử.
Số nguyên tử khối:
\(\overline{A_{Cu}}=\dfrac{65\cdot27+63\cdot73}{100}=63,54\)
\(\%m_{^{63}Cu}=\dfrac{63\cdot0,73}{63,54+2\cdot35,5}\cdot100\%=34,18\%\)

Phần trăm đồng vị $^{63}Cu$ là : $\dfrac{105}{105 + 245}.100\% = 30\%$
Phần trăm đồng vị $^{65}Cu$ là : $100\% -30\% = 70\%$
Nguyên tử khối Cu : $M = 63.30\% + 65.70\% = 64,4(đvC)$