Cho m gam hỗn hợp bột X gồm 3 kim loại Zn,Cr,Sn có số mol bằng nhau tác dụng hết với dd HCl loãng , nóng , dư thu được dd Y và khí H2 . Cô cạn dd Y thu được 8,98 gam muối khan . Nếu cho m gam X tác dụng hoàn toàn với O2 dư để tạo ra 3 oxit thì thể tích O2 (đktc) phản ứng là bao nhiêu ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn đáp án B
Gọi số mol mol mỗi kim loại là x mol
Khi cho X tác dụng HCl hình thành ZnCl2: x mol, CrCl2: x mol, SnCl2: x mol → 136x + 123x + 190x = 8,98 → x = 0,02 mol
Khi cho X phản ứng với O2 hình thành ZnO, Cr2O3, SnO2
Bảo toàn electron ta có nO2 pứ = ![]() = 0,045 mol → V = 1,008 lít.
= 0,045 mol → V = 1,008 lít.
⇒ Chọn B

Ba kim loại Zn, Cr, Sn khi tác dụng với HCl loãng nóng đều bị oxi hóa lên số oxi hóa +2. Gọi X ¯ là kim loại chung thỏa mãn tính chất khi tác dụng với HCl giống với 3 kim loại trên. Vì trong hỗn hợp ban đầu 3 kim loại có số mol bằng nhau nên ta có:

Muối khan khi cô cạn dung dịch Y là hỗn hợp muối clorua của 3 kim loại (XCl2)

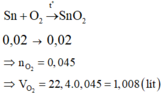
Đáp án D

Đáp án D
Đặt Zn, Cr,Sn là x mol → ZnCl2 : x mol, SnCl2 : x mol và CrCl2 : x mol
→ x =0,02 mol
Bảo toàn O trong phương trình đốt cháy có 2nO2 = x + 2x + 3/2 x =0,09
→ VO2= 1,008 lít

\(n_{Cl_2}=\dfrac{2,1168}{22,4}=0,0945\left(mol\right)\)
=> nCl(muối) = 0,39 - 0,0945 = 0,201 (mol)
=> nAgCl = 0,201 (mol)
=> mAgCl = 0,201.143,5 = 28,8435 (g)
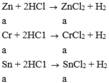
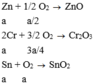

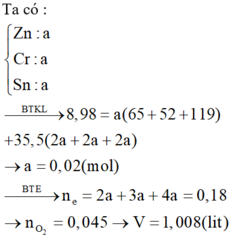

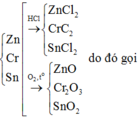
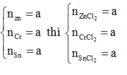

Zn +2HCl ->ZnCl2 + H2
Cr + 2HCl -> CrCl2 + H2
Sn + 2HCl -> SnCl2 + H2
Ta có: nZn=nCr=nSn=x mol
Theo phương trình: nZn=nZnCl2; nCr=nCrCl2; nSn=nSnCl2
Cô cạn dung dịch Y được muối gồm ZnCl2 x mol; CrCl2 x mol và SnCl2 x mol.
->136x +123x +190x=8,98 -> x=0,02 mol
Nếu cho lượng X trên phản ứng với O2 dư.
Zn + 1/2 O2 --> ZnO
2Cr + 3/2 O2 -> Cr2O3
Sn +O2 -> SnO2
-> nO2=1/2nZn + 3/4nCr +nSn=0,045 mol -> V O2=0,045.22,4=1,008 lít