Nguyên tố R có cấu hình e lớp ngoài cùng là ns2 np5 . Trong Hợp chất khí với hiđrô, hiđrô chiếm 1,234% khối lượng. Xác định tên R
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


CTHH hợp chất với hidro là RH
Có \(\dfrac{M_R}{M_R+1}.100\%=97,26\%\)
=> MR = 35,5(Cl)
=> R là Cl, có số hiệu nguyên tử là 17

a)
Nguyên tố R có cấu hình e lớp ngoài cùng là ns1
=> Công thức oxit cao nhất của R là R2O
\(\dfrac{2.M_R}{2.M_R+16}.100\%=74,19\%=>M_R=23\left(Na\right)\)
b)
TH1:
\(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
PTHH: 2Na + 2H2O --> 2NaOH + H2
______0,2----------------------->0,1
=> VH2 = 0,1.22,4 = 2,24 (l)
TH2:
\(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
PTHH: 2Na + 2HCl --> 2NaCl + H2
_____0,2------------------------->0,1
=> VH2 = 0,1.22,4 = 2,24 (l)
c)
K --> K+ + 1e
O + 2e --> O2-
2 ion K+ và O2- trái dấu nên hút nhau bởi lực hút tĩnh điện
2K+ + O2- --> K2O

%H=100-91.176=8.824%
Gọi CTPT là RH3
R:3=91.176:8.824
=>R~31(P)
Vậy R là P

a)
R thuộc họ p và có 5 electron ở lớp ngoài cùng => R thuộc nhóm VA , trong hợp chất oxit cao nhất với oxi R có hóa trị V
=> CT : R2O5
b)
%R = \(\dfrac{2R}{2R+16.5}\).100% = 43,66% => R = 31(g/mol)
=> R là photpho (P)

Nguyên tố R tạo thành hợp chất khí với hiđro có công thức là RH 4 sẽ tạo thành hợp chất oxit cao nhất là RO 2 có phần trăm khối lượng của nguyên tô R :
100% - 72,73% = 27,27%
72,73% phân tử khối của RO 2 ứng với 16 x 2 = 32 (đvC).
27,27% phân tử khối của RO 2 ứng với nguyên tử khối của nguyên tố R là :
32x27,27/72,73 = 12 (đvC) => R là cacbon (C)

Chọn B
Công thức hợp chất khí là X H 2
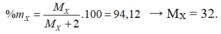
Vậy X là lưu huỳnh (S).
Công thức oxit cao nhất là S O 3
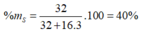

R có CH e lớp ngoài cùng ns2 np5 nên R nhóm VIIA
\(\rightarrow\) Hợp chất khí với H là HR
%H= 1,234%\(\rightarrow\)M HR= 1:1,234%= 81
\(\rightarrow\) M HR= 81-1=80.
Vậy R là brom (Br)