Cho 11 gam hỗn hợp 2 kim loại Al và Fe vào dung dịch HNO3 loãng thu, được 6,72 lít khí NO(đktc) duy nhất. Tính khối lượng của Al và Fe trong hỗn hợp ban đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Theo gt ta có: $n_{NO}=0,3(mol)$
Gọi số mol của Al và Fe trong 11g hỗn hợp lần lượt là a;b(mol)
Ta có: \(\left\{{}\begin{matrix}27a+56b=11\\3a+3b=0,9\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
Suy ra $m_{Fe}=5,4(g);m_{Al}=5,6(g)$

Các quá trình OXH - K
Al0 → Al+3 + 3e N+5 + 3e → N+2
Fe0 → Fe+3 + 3e
nNO = \(\dfrac{3,36}{22,4}\)mol . Gọi số mol của Al va Fe lần lượt là x và y mol ta có hệ:
\(\left\{{}\begin{matrix}27x+56y=5,5\\3x+3y=0,45\end{matrix}\right.\)=> x = 0,1 và y = 0,05 mol
mAl = 0,1.27 = 2,7 gam
mFe = 0,05.56 = 2,8 gam

Đáp án A
Gọi số mol các kim loại là Al: a mol; Fe: b mol.
Ta có:
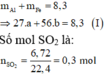
Sơ đồ phản ứng:
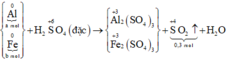
Các quá trình nhường, nhận electron:


PTHH: Al + 4HNO3 \(\rightarrow\)Al(NO3)3 + NO + 2H2O
1 4 1 1 2
Fe + 4HNO3\(\rightarrow\) Fe(NO3)3 + NO + 2H2O
1 4 1 1 2
nNO = \(\dfrac{6,72}{22,4}\) = 0,3 (mol)
Gọi a,b là số mol Al và Fe :
=> 27a + 56b = 11 (1)
a + b = 0,3 (2)
Từ (1) và (2) => a= 0,2 mol ; b=0,1 mol.
mAl trong hh đầu là = 0,2.27 = 5,4g
mFe trong hh đầu là = 0,1.56 = 5,6g

\(n_{Al}=a\left(mol\right),n_{Fe}=b\left(mol\right)\)
\(m=27a+56b=6.95\left(g\right)\left(1\right)\)
\(n_{NO_2}=\dfrac{10.08}{22.4}=0.45\left(mol\right)\)
Bảo toàn e :
\(3a+3b=0.45\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.05,b=0.1\)
\(m_{Al}=0.05\cdot27=1.35\left(g\right)\)
\(m_{Fe}=0.1\cdot56=5.6\left(g\right)\)

gọi nfe =x nal =y
bảo toàn khối lượng ta có 56x +27y =11 (1)
bảo toàn e ta có 3x +3y =0,3 nhân 3 (2)
giải hệ phương trình là ra

Gọi số mol Al và Fe lần lượt là a;b
$\Rightarrow 27a+56b=8,3$
Bảo toàn e ta có: $3a+3b=0,6$
Giải hệ ta được $a=b=0,1$
$\Rightarrow m_{Al}=2,7(g);m_{Fe}=5,6(g)$
\(n_{Al}=a\left(mol\right),n_{Fe}=b\left(mol\right)\)
\(m=27a+56b=8.3\left(g\right)\left(1\right)\)
\(n_{SO_2}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(BTe:\)
\(3a+3b=0.3\cdot2=0.6\left(2\right)\)
\(\left(1\right),\left(2\right):a=b=0.1\)
\(m_{Al}=0.1\cdot27=2.7\left(g\right)\)
\(m_{Fe}=5.6\left(g\right)\)