Hoà tan hoàn toàn a gam kim loại M có hoá trị không đổi vào b gam dung dịch HCl được dung dịch D.Thêm 240 gam dung dịch NaHCO3 7% vào D thì vừa đủ tác dụng vừa hết lượng HCl còn dư, thu được dung dịch E trong đó nồng độ phần trăm của NaCL và muối clorua kim loại M tương ứng 2,5% và 8,12 %. Thêm tiếp lượng dư NaOH vào E, sau đó lọc lấy kết tủa rồi nung tới khối lượng không đổi thì thu được 16 gam chất rắn .Xác định kim loại và nồng độ phần trăm dung dịch đã dùng ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


BTKL: mD + mNaHCO3 = mCO2 + mE
mD + 179,88 = 44.0,2 + 492 => mD = 320,92
BTKL: mMg + mddHCl = mH2 + mD
=> 24 . 0,4 + mddHCl = 2 . 0,4 + 320,92 => mddHCl = 312,12
=> C%HCl = 11,69%

Gọi n lá hóa trị của M
Gọi $n_{Fe} = a(mol) ; n_M = b(mol)$
$\Rightarrow 56a + Mb = 10,4(1)$
$Fe + 2HCl \to FeCl_2 + H_2$
$2M + 2nHCl \to 2MCl_n + nH_2$
Theo PTHH :
$n_{H_2} = a + 0,5bn = \dfrac{6,72}{22,4} = 0,3(2)$
Bảo toàn nguyên tố với Fe,M
$n_{Fe_2O_3} = 0,5a(mol)$
$n_{M_2O_n} = 0,5b(mol)$
Ta có :
0,5a.160 + 0,5b(2M + 16n) = 16(3)
Từ (1)(2)(3) suy ra a = 0,1 ; Mb = 4,8 ; bn = 0,4 => b = 0,4/n
Suy ra :
$M = Mb : b = 4,8 : 0,4/n = 12n$
Với n = 2 thì M = 24(Magie)
$n_{FeCl_2} = a = 0,1(mol)$
$n_{MgCl_2} = n_{Mg} = 0,4 : n = 0,4 : 2 = 0,2(mol)$
Vậy :
$m_{FeCl_2} = 0,1.127 = 12,7(gam)$
$m_{MgCl_2} = 0,2.95 = 19(gam)$

\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
a.
\(A+2HCl\rightarrow ACl_2+H_2\)
0,25 0,5 0,25 0,25
=> \(M_A=\dfrac{16,25}{0,25}=65\)
Vậy kim loại A là Zn.
b.
\(m_{dd.HCl}=\dfrac{0,5.36,5.100}{18,25}=100\left(g\right)\)
c.
\(V_{dd.HCl}=\dfrac{m_{dd.HCl}}{D_{dd.HCl}}=\dfrac{100}{1,2}=83\left(ml\right)\)
Đổi: 83 ml = 0,083 (l)
\(CM_{dd.HCl}=\dfrac{0,5}{0,083}=6M\)
(Nếu V không đổi thì mới tính được CM dd muối sau pứ, còn đề không nói thì mình cũng không biết nữa).

a)
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$n_{Al} = \dfrac{10,8}{27} = 0,4(mol)$
Theo PTHH : $n_{HCl} = 3n_{Al} = 1,2(mol)$
$\Rightarrow m = \dfrac{1,2.36,5}{14,6\%} = 300(gam)$
b) $n_{H_2} = \dfrac{3}{2}n_{Al} = 0,6(mol)$
$M_xO_y + yH_2 \xrightarrow{t^o}xM + yH_2O$
Theo PTHH : $n_{oxit} = \dfrac{1}{y}.n_{H_2} = \dfrac{0,6}{y}(mol)$
$\Rightarrow \dfrac{0,6}{y}(Mx + 16y) = 34,8$
$\Rightarrow \dfrac{x}{y}.M = 42$
Với x = 3 ; y = 4 thì $M = 56(Fe)$
Vậy oxit là $Fe_3O_4$

Bài 1:
Ta có: \(n_{HCl}=0,08.1=0,08\left(mol\right)\)
BTNT H và O, có: \(n_{H_2O}=\dfrac{1}{2}n_{HCl}=0,04\left(mol\right)\)
⇒ nO (trong oxit) = nH2O = 0,04 (mol)
Có: mhh = mFe + mO
⇒ mFe = 2,32 - 0,04.16 = 1,68 (g)
Bài 2:
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
BTNT H, có: \(n_{HCl}=2n_{H_2}=0,4\left(mol\right)\)
\(\Rightarrow V_{ddHCl}=\dfrac{0,4}{0,5}=0,8\left(l\right)\)
Bạn tham khảo nhé!
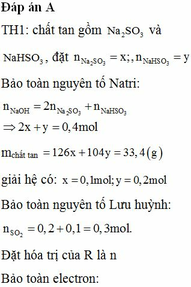

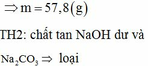
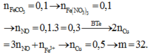
Thứ tự của ảnh: 2-1-3
-chúc bn hc tốt- 🥰