Một loại thủy tinh pha lê có thành phần ứng với công thức:
120SiO2.Al2(SiO3)3.3CaSiO3.25PbSiO3.20Na2SiO3.22.K2SiO3. Hãy tính thành phần phần trăm của Si có trong thủy tinh pha lê trên.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Đặt công thức của thủy tinh là (Na2O)x. (CaO)y.(SiO2)z
Ta có:

= 0,42: 0,42: 0,84= 1:1:2
→Công thức của thủy tinh là Na2O. CaO.2SiO2
→ 1 mol Na2O kết hợp với 1 mol CaO và 2 mol SiO2

Đáp án A
Tỷ lệ số mol của các oxit: nNa2O : nCaO : nSiO2 = 13/62 = 11,7/56 = 75,3/60
= 0,21 : 0,21 : 1,255 = 1:1:6
Vậy công thức của loại thủy tinh này: Na2O.CaO. 6SiO2

\(n_{thủy-tinh}=\dfrac{6,77.1000}{677}=10\left(kmol\right)\\ n_{K_2CO_3}=n_{PbCO_3}=n_{ttinh}=10\left(kmol\right)\\ n_{SiO_2}=6n_{ttinh}=60\left(kmol\right)\)
Suy ra:
\(m_{K_2CO_3}=10.138=1380\left(kg\right)\\ m_{PbCO_3}=10.267=2670\left(kg\right)\\ m_{SiO_2}=60.60=3600\left(kg\right)\)

Số mol thuỷ tinh là:
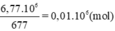
Từ công thức của thuỷ tinh suy ra:
nK2CO3 = nPbCO3 = nthuỷ tinh = 0,01.106 mol
Khối lượng K2CO3 = 0,01. 106. 138(g) = 1,38. 106(g) = 1,38 (tấn)
Khối lượng PbCO3 = 0,01. 106. 267(g) = 2,67. 106(g) = 2,67(tấn)
nSiO2 = 6nthuỷ tinh = 6. 0,01. 106 mol = 0,06. 106 mol
Khối lượng SiO2 = 0,06. 106. 60(g) = 3,6 tấn

a) 5kg thuỷ tinh đặc biệt , nhà sản xuất cần thêm vào số gam chất khác là :
\(519\times5=2595\left(g\right)\)
b) Đổi : 5kg thuỷ tinh đặc biệt \(=5000g\)
5 thấu kính đó nặng số gam là :
\(5000+2595=7595\left(g\right)\)
Mỗi thấu kính nặng số gam là :
\(7595:5=1519\left(g\right)\)
đs....
Ta có M 120SiO2.Al2(SiO3)3.3CaSiO3.25PbSiO3.20Na2SiO3.22K2SiO3
\(\text{=20685}\)
→%mSi=(120.28+28.3+3.28+25.28+20.28+22.28)/20685\(\text{=26.13%}\)