Hòa tan một oxit kim loại M thuộc nhóm II bằng một lượng vừa đủ dung dịch H2SO4 10% ta thu được dung dịch muối có nồng độ 11,8%. Tìm kim loại M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
Hướng dẫn Gọi số mol oxit MO = x mol
MO + H2SO4 ® MSO4 + H2O
(mol): x x x
Ta có: (M + 16)x = a
Khối lượng dung dịch axit H2SO4 ban đầu = ![]() = 560x (gam)
= 560x (gam)
Khối lượng dung dịch sau phản ứng = a + 560x = (M + 16)x + 560x
Theo bài: C% (MSO4) = 20% nên: ![]()
Từ đây tìm được M = 24 (magie). Oxit kim loại cần tìm là MgO

Đáp án B
Hướng dẫn
Gọi số mol oxit MO = x mol.
MO + H2SO4 → MSO4 + H2O
(mol): x x x
Ta có: (M + 16)x = a
Khối lượng dung dịch axit H2SO4 ban đầu ![]() = 560x (gam)
= 560x (gam)
Khối lượng dung dịch sau phản ứng = a + 560x = (M + 16)x + 560x.
Theo bài: C% (MSO4) = 20% nên: ![]()
Từ đây ta tìm được M = 24 (magie). Oxit kim loại cần tìm là MgO

Chọn C
Gọi công thức của oxit hóa trị II là RO
Đặt mol RO = 1 (mol)
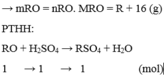
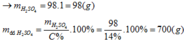
![]()
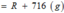
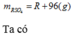

Vậy công thức của oxit kim loại là MgO

CT oxit : MO
Đặt số mol oxit phản ứng là 1 mol
\(MO+H_2SO_4\rightarrow MSO_4+H_2O\)
\(m_{ddH_2SO_4}=\dfrac{1.98}{15,8\%}=620,25\left(g\right)\)
\(m_{ddsaupu}=620,25+M+16=M+636,25\left(g\right)\)
Ta có : \(C\%_{MSO_4}=\dfrac{M+96}{M+636,25}.100=22,959\)
=> M=65 (Zn)
=> Oxit kim loại : ZnO (Kẽm oxit)

Đáp án A.
Coi nH2SO4 = 1 mol
M(OH)2 + H2SO4 → MSO4 + 2H2O
mdd H2SO4= 1.98.100/20 = 490 (gam)
=> mdd sau = (M + 34) + 490 = M + 524


Đáp án C
Giả sử đem 1 mol H2SO4 phản ứng, ta có:
![]()
mdung dịch sau phản ứng = 490 + (M + 34) (gam)
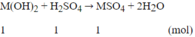
Theo đề bài ta có:
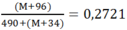
⇒ M = 64: Đồng
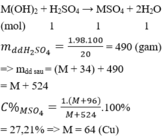
giả sử ban đầu có 98g dung dịch H2SO4. Gọi a là số mol của H2SO4
Ta có 10% = 98a.100%/98
=> số mol H2SO4: a = 0,1.
ptpu: MO + H2SO4 ---------------> MSO4 + H2O
0,1 0,1 0,1
Ta có: 11,8 = 0,1.(M + 98).100/[98+(16+M).0,1] => M=24 (Mg)