Một nguyên tử M kết hợp với 3 nguyên tử H tạo thành hợp chất với hidro. Trong phân tử, khối lượng H chiếm 17,65%. Xác định nguyên tố M và viết công thức hóa học của hợp chất
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi công thức tổng quát là $XH_4$
\(\%H=25\%\\ \Rightarrow \dfrac{4}{X+4}.100\%=25\%\\ \Rightarrow X=12\\ Tên:\ Cacbon\\ CTHH:\ CH_4\)

Gọi CTHH là $H_3X$
$\%H = \dfrac{3}{3 + X}.100\% = 17,65\%$
$\Rightarrow X = 14$
Vậy X là Nito
Hợp chất MH3
%H=3.1/M+3.100%=17,65%
⇔3/M+3=0,1765
⇔0,1765M=2,4705
⇔M≈14(g/mol)
⇒Nitơ
có gì sai mong bạn thôm cảm

Gọi công thức của hợp chất là S i x H y .
Theo đề bài ta có:
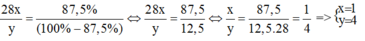
CTHH của hợp chất là S i H 4 .
Phân tử khối là: 28 + 4.1 = 32 ( đvC)

a) M = 2.40 = 80 (g/mol)
b) CTHH: XO3
=> MX + 3.16 = 80
=> MX = 32(S)
=> CTHH: SO3
CTHH dạng TQ là MH3
Có :
%H = (3. MH / MMH3).100%=17.65%
=> %H =(3/MMH3) =0.1765
=> MMH3 = 3/0.1765 = 17 (g)
hay 1 . MM + 3 . MH =17g
=> MM + 3=17(g)
=> MM = 17-3=14(g)
=> M là nguyên tử thuộc nguyên tố hóa học Nito
=> CTHH củaaX là NH3
Nguyên tố M là nitơ nha