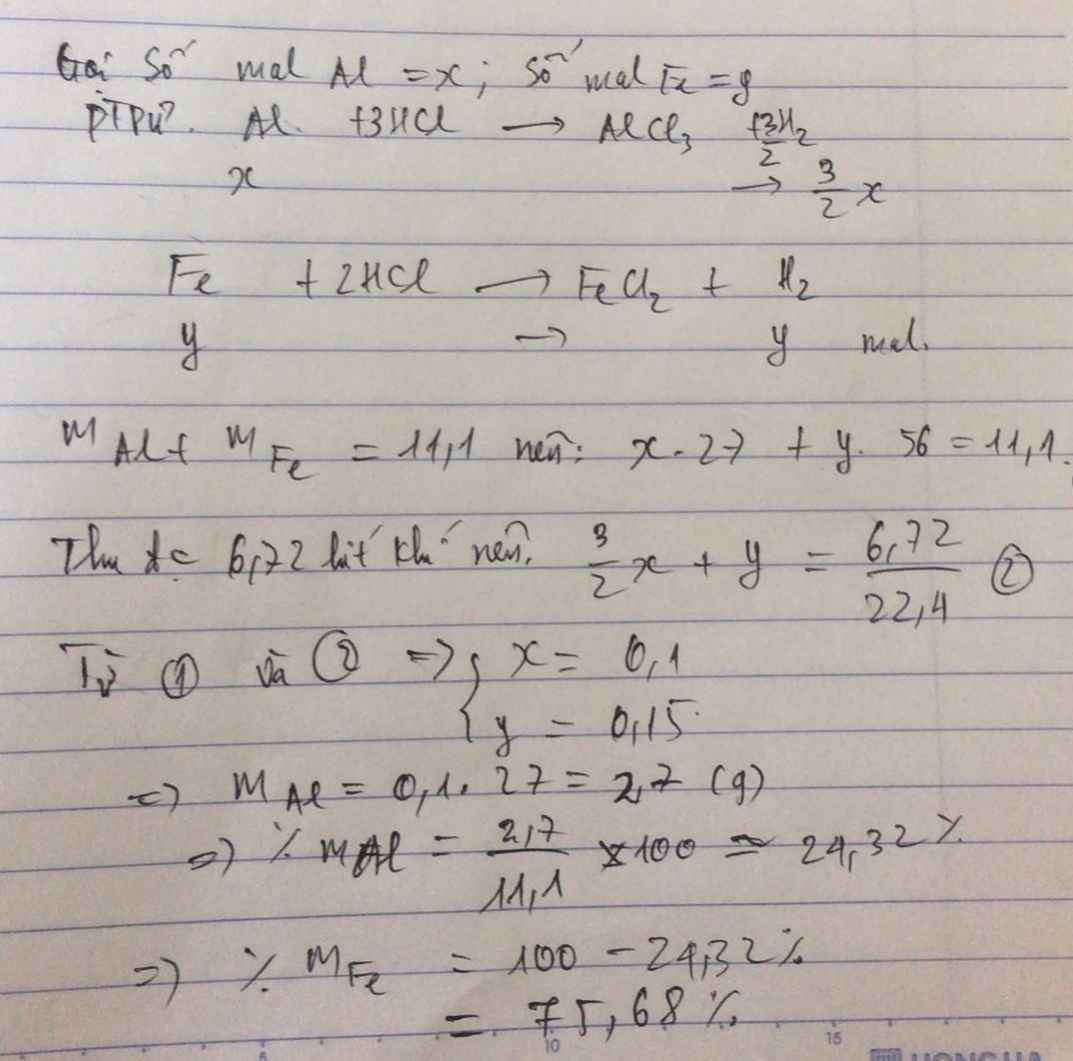a) Cho Fe tác dụng vừa hết với dung dịch chứa 7,3 g HCl có PTHH là Fe + 2HCl → FeCl2 +H2. Khối lượng sắt thu được là
b) Cho kim loại R hóa trị III tác dụng hết với dung dịch H2SO4 thu được 6,72 lít H2 đktc và 34,2 gam R2(SO4)3. Biết PTHH là 2R + 3H2SO4 → R2(SO4)3 + 3H2. R là
c) Cho 8 gam Fe2O3 tác dụng vừa hết với HCl: Fe2O3 + 6HCl → FeCl3 +3H2O. Khối lượng FeCl3 là
d) Cho kim loại nhôm (Al) tác dụng vừa hết với 7,3 g HCl: 2Al+ 6HCl → 2AlCl3 +3H2. Tính thể tích khí H2 sinh ra ở đktc.
e) Cho 5,1 gam Al2O3 tác dụng vừa hết với HCl: Al2O3 + 6HCl → AlCl3 +3H2O. Tính khối lượng AlCl3 tạo thành.
f) Cho Mg tác dụng hết với dung dịch HCl thu được 4,48 lít H2 đktc, biết rằng R có phản ứng sau: Mg + 2HCl → MCl2 + H2. Số mol HCl phản ứng là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a.Fe+2HCl\rightarrow FeCl_2+H_2\)
_________0,1__________0,1
\(b.n_{H_2}=\dfrac{0,2}{2}=0,1\left(mol\right)\\ \Rightarrow m_{FeCl_2}=0,1.127=12,7\left(g\right)\)

Đặt \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Na}=b\left(mol\right)\end{matrix}\right.\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
a--------------------------->a
\(2Na+2HCl\rightarrow2NaCl+H_2\)
b---------------------------->0,5b
Ta có: \(m_M=\dfrac{1}{2}.\left(m_{Fe}+m_{Na}\right)=\dfrac{1}{2}.\left(56a+23b\right)=28a+11,5b\left(g\right)\)
PTHH: \(M+2HCl\rightarrow MCl_2+H_2\)
(a+0,5b)<----------------(a+0,5b)
\(\Rightarrow M_M=\dfrac{28a+11,5b}{a+0,5b}\\ \Rightarrow\dfrac{28a}{a}>M_M>\dfrac{11,5a}{0,5a}\\ \Leftrightarrow28>M_M>23\)
Vậy M là Magie (Mg)

\(n_{H2\left(dktc\right)}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
a) Pt : \(2R+3H_2SO_4\rightarrow R_2\left(SO_4\right)_3+3H_2|\)
2 3 1 3
0,2 0,3
\(n_R=\dfrac{0,3.2}{3}=0,2\left(mol\right)\)
⇒ \(M_R=\dfrac{5,4}{0,2}=27\left(dvc\right)\)
Vậy kim loại R là nhôm
b) \(2Al+6H_2SO_{4\left(đặc,nóng\right)}\rightarrow Al_2\left(SO_4\right)_3+3SO_2+6H_2O|\)
2 6 1 3 6
0,2 0,3
\(n_{SO2}=\dfrac{0,3.3}{2}=0,3\left(mol\right)\)
\(V_{SO2\left(dktc\right)}=0,3.22,4=6,72\left(l\right)\)
Chúc bạn học tốt
a) PTHH: \(2R+3H_2SO_4\rightarrow R_2\left(SO_4\right)_3+3H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\) \(\Rightarrow n_R=0,2\left(mol\right)\)
\(\Rightarrow M_R=\dfrac{5,4}{0,2}=27\) \(\Rightarrow\) R là Nhôm (Al)
b) PTHH: \(2Al+6H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}Al_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
Theo PTHH: \(n_{SO_2}=0,3\left(mol\right)\) \(\Rightarrow V_{SO_2}=0,3\cdot22,4=6,72\left(l\right)\)

Gọi số mol Al, Fe là a, b (mol)
=> 27a + 56b = 11,1 (1)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a----------------------->1,5a
Fe + 2HCl --> FeCl2 + H2
b------------------------>b
=> 1,5a + b = 0,3 (2)
(1)(2) => a = 0,1; b = 0,15
=> \(\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,1.27}{11,1}.100\%=24,32\%\\\%m_{Fe}=\dfrac{0,15.56}{11,1}.100\%=75,68\end{matrix}\right.\)