Trong tự nhiên đồng có 2 đồng vị là 65Cu và 63Cu với tỉ số 63Cu/65Cu=105/245. Tính nguyên tử khối của Cu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi % 63Cu là a% => % 65Cu = (100-a ) %
Theo bài ra : \(\frac{a}{100-a}=\frac{105}{245}\) => a = 30%
\(M_{Cu}=\frac{63.30+65.70}{100}=64,4\) ( u)
nguyên tử khối trung bình của Cu
Mtb(Cu) = 105.63+245.65 =64,4 (g/mol)
105 + 245

Đáp án A
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
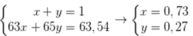
Phần trăm khối lượng của 63Cu trong CuSO4 là
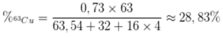

Đồng vị \(^{65}Cu\) chiếm 27% về số nguyên tử.
\(\Rightarrow\)Đồng vị \(^{63}Cu\) chiếm 73% về số nguyên tử.
Số nguyên tử khối:
\(\overline{A_{Cu}}=\dfrac{65\cdot27+63\cdot73}{100}=63,54\)
\(\%m_{^{63}Cu}=\dfrac{63\cdot0,73}{63,54+2\cdot35,5}\cdot100\%=34,18\%\)

Đáp án B
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
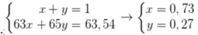
Phần trăm khối lượng của 63Cu trong Cu2O là
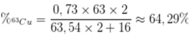

nguyên tử khối trung bình của Cu
Mtb(Cu) = 105.63+245.65 =64,4 (g/mol)
105 + 245