Đốt cháy 5,6 gam Fe nung đỏ trong bình oxi thu được 7.36 gam hỗn hợp A gồm Fe2O3; Fe3O4; FeO và 1 phần Fe còn lại. Hòa tan hoàn toàn hỗn hợp A bằng V ml dung dịch HNO3 2M (đủ) thu được a lít khí NO2. Tính a và V
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nFe = 0,1 mol. m O2 = 7,36 - 5,6 = 1,76 gam => n O2 = 0,055 mol
Đặt nNO = x, nNO2 = y
Ta có hệ: bảo toàn electron: 3.0,1 - 0,055.4 = 3x + y
30x + 44y / ( x+y) = 19.2
=> x= 0,02, y =0,02
=> V = 0,04.22,4 = 8,96 lít

Bảo toàn Fe: nFe(bđ) = 0,012 + 0,12 + 0,01.3 + 0,01.2 = 0,182 (mol)
=> m = 0,182.56 = 10,192 (g)

Z gồm CO2 và O2 dư
$C + O_2 \xrightarrow{t^o} CO_2$
$n_{CO_2} =n_{O_2\ pư} = n_C = \dfrac{1,128}{12} = 0,094(mol)$
Gọi $n_{O_2} = 2a \to n_{không\ khí} = 3a(mol)$
Trong Y :
$n_{O_2} = 2a + 3a.20\% = 2,6a(mol)$
$n_{N_2} = 3a.80\% = 2,4a(mol)$
Trong Z :
$n_{CO_2} = 0,094(mol)$
$n_{N_2} = 2,4a(mol)$
$n_{O_2\ dư} = n_{O_2} - n_{O_2\ pư} = 2,6a - 0,094(mol)$
m CO2 =0,094.44 = 4,136(gam)
=> m Z = 4,136 : 27,5% = 15,04(gam)
SUy ra :
4,136 + 2,4a.28 + (2,6a - 0,094).32 = 15,04
=> a = 0,0925
=> n O2 = 0,0925.2 = 0,185(mol)
m X = 43,5 : 46,4% = 93,75(gam)
Bảo toàn khối lượng : m = 93,75 + 0,185.32 = 99,67(gam)

PTHH: Fe + 2HCl --> FeCl2 + H2
FeS + 2HCl --> FeCl2 + H2S
=> \(n_{Fe}+n_{FeS}=n_{H_2}+n_{H_2S}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Và 56.nFe + 88.nFeS = 18,8
=> \(\left\{{}\begin{matrix}n_{Fe}=0,1\left(mol\right)\\n_{FeS}=0,15\left(mol\right)\end{matrix}\right.\)
Bảo toàn S: nCaSO3 = 0,15 (mol)
=> m = 0,15.120 = 18 (g)
=> B
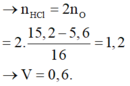
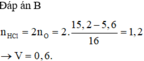
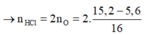
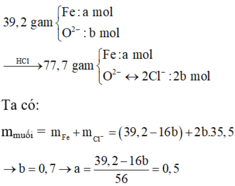
nO = 0,11 (mol) , nFe = 0,1 (mol)
Bảo toàn e , ta suy ra : 3nFe- 2nO = nNO2 = 0,08 (mol) => a = 1,792 (l)
nHNO3 = 0,08.2=0,16 (mol) => V = 0,08 (l) =80 (ml)