Dùng 4,48l H2 (đktc) khử 116g Fe3O4 ở nhiệt độ cao . Sau phản ứng thu được chất rắn A gồm mấy chất . Cho toàn bộ chất rắn A vào 400g dung dịch HCl 14,6% thu được khí B (đktc) là bao nhiêu lít và dung dịch C . Tìm C% các chất trong dung dịch C
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


H2 khử hỗn hợp thì chỉ Fe2O3 và CuO bị khử , MgO không bị khử bởi H2
Fe2O3 + 3H2 → 2Fe + 3H2O (1)
CuO + H2 → Cu + H2O
=> Chất rắn A gồm MgO chưa phản ứng , Cu và Fe.
Khi A tác dụng với HCl thì Cu không phản ứng nên 6,4 gam chất rắn không tan là Cu => nCu = 6,4/64 =0,1 mol = nCuO.
=> mCuO = 0,1.80 = 8 gam
Fe + 2HCl → FeCl2 + H2
MgO + 2HCl → MgCl2 + H2O
nH2 = 4,48/22,4 = 0,2 mol
=> nFe = 0,2 mol , theo (1) => nFe2O3 = 0,05mol
<=> mFe2O3 = 0,05 .160 = 8 gam
=> mMgO = 28- 8 - 8 = 12 gam
%MgO = \(\dfrac{12}{28}.100\)= 42,85% , % Fe2O3 = %CuO = \(\dfrac{8}{28}.100\) = 28,575%

a)
Gọi $n_{Fe_3O_4} = a(mol) ; n_{ZnO} = b(mol)$
Ta có : 232a + 81b = 70,7(1)
$Fe_3O_4 + 4H_2 \xrightarrow{t^o} 3Fe + 4H_2O$
$ZnO + H_2 \xrightarrow{t^o} Zn + H_2O$
$Fe + 2HCl \to FeCl_2 + H_2$
$Zn + 2HCl \to ZnCl_2 + H_2$
Theo PTHH :
$n_{H_2} = 3a + b = \dfrac{20,16}{22,4} = 0,9(mol)(2)$
Từ (1)(2) suy ra a = 0,2 ; b = 0,3
%\%m_{Fe_3O_4} = \dfrac{0,2.232}{70,7}.100\% = 65,6\%$
$\%m_{ZnO} = \dfrac{0,3.81}{70,7}.100\% = 34,4\%$
b)
$n_{HCl} = 2n_{H_2} = 1,8(mol) \Rightarrow m_{dd\ HCl} = \dfrac{1,8.36,5}{14,6\%} = 450(gam)$
$m_{dd\ B} = 0,2.3.56 + 0,3.65 + 450 - 0,9.2 = 501,3(gam)$
$C\%_{FeCl_2} = \dfrac{0,6.127}{501,3}.100\% = 15,2\%$
$C\%_{ZnCl_2} = \dfrac{0,3.136}{501,3}.100\% = 8,14\%$

a) \(CuO+CO\underrightarrow{t^o}Cu+CO2\)
\(FexOy+yCO\underrightarrow{t^o}xFe+yCO2\)
\(Fe+2HCl\rightarrow FeCl2+H2\)
Ta có:
\(n_{H2}=\dfrac{4,704}{22,4}=0,21\left(mol\right)\)
\(\Rightarrow n_{Fe}=0,21\left(mol\right)\Rightarrow m_{Fe}=11,76\left(g\right)\)
\(\Rightarrow m_{Cu}=14,32-11,76=2,56\left(g\right)\)
\(\Rightarrow n_{Cu}=\dfrac{2,56}{64}=0,04\left(mol\right)\)
\(\Rightarrow n_{CuO}=0,04\left(mol\right)\)
\(\Rightarrow\%m_{CuO}=\dfrac{0,04.80}{19,44}.100\%=16,46\%\)
\(\Rightarrow\%m_{FexOy}=100-16,46=83,54\%\)
b) \(m_{FexOy}=19,44-0,04.80=16,24\left(g\right)\)
\(n_{Fe}=0,21\left(mol\right)\)
\(\Rightarrow n_{FexOy}=\dfrac{1}{x}n_{Fe}=\dfrac{0,21}{x}\left(mol\right)\)
\(M_{FexOy}=\dfrac{16,24}{\dfrac{0,21}{x}}=\dfrac{232}{3}x\)
| x | 1 | 2 | 3 |
| \(M_{FexOy}\) | 77,33(loại) | 154,6(loại) | 232(TM) |
\(\Rightarrow FexOy\) là \(Fe3O4\)
Chúc bạn học tốt ^^
Câu a tính khối lượng mỗi chất trong hh ban đầu phải không ạ?
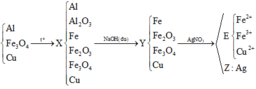
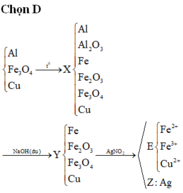

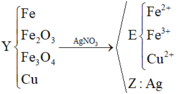

Sai rồi bạn
:))
14,6%.400/36,5=16 ???
sửa chỗ đó là đc, cách làm là vậy :))