B1. Cho 8g hỗn hợp A gồm MgO và CuO hòa tan vừa đủ trong 150 g dd HCl 7,3% thu được dd B
a) Tính % khối lượng các chất A
b) Dung dịch B có nồng độ bao nhiêu %
c) Nếu đem hòa tan hết A trong dung dịch axit sunfuric 2M thì tốn hết mấy gam dung dịch axit có khối lượng riêng là 1,2g/ml

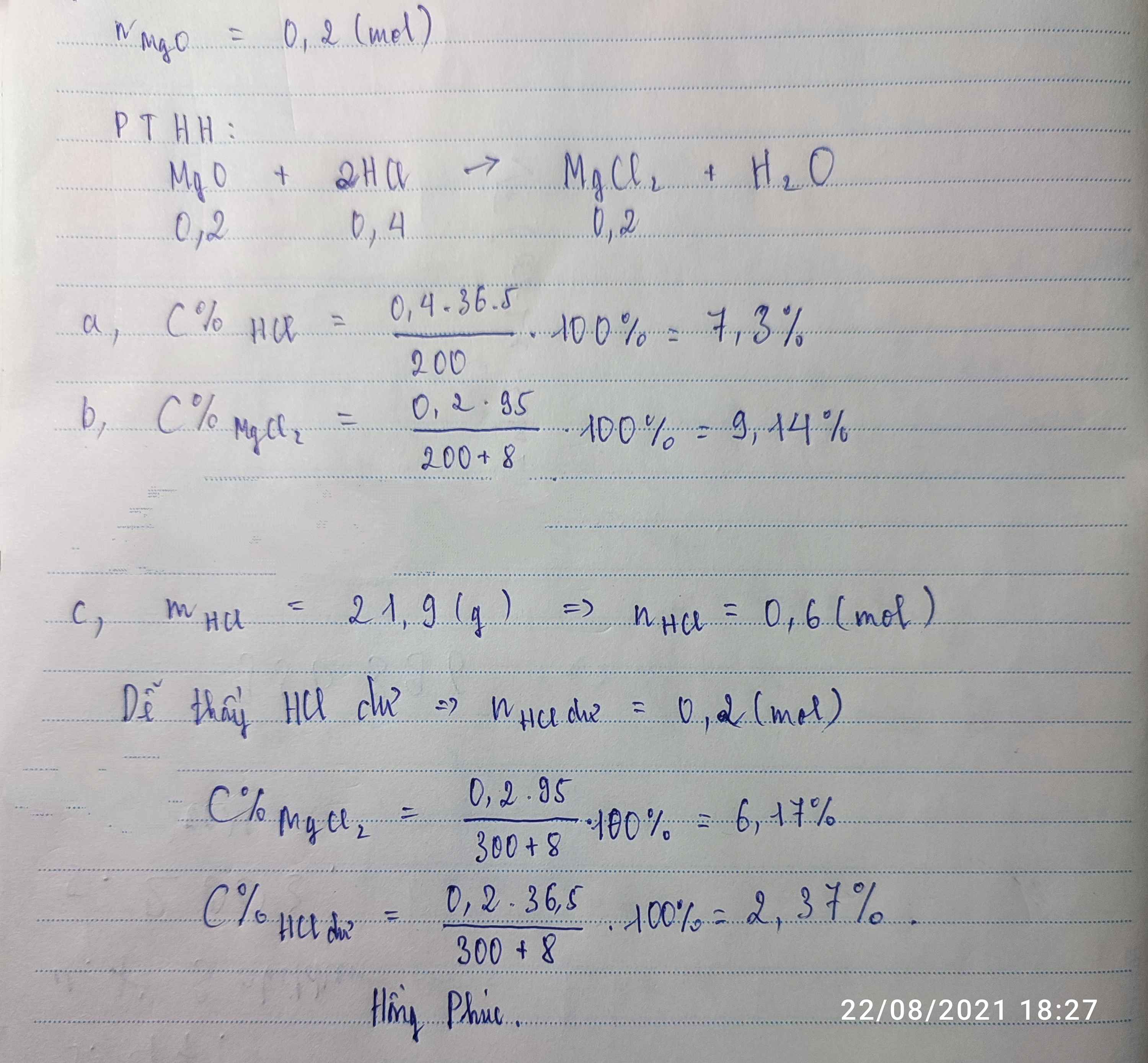

a) PTHH: MgO + 2 HCl-> MgCl2 + H2O (1)
CuO +2 HCl -> CuCl2 + H2O (2)
Gọi x,y lần lượt là số mol của MgO và CuO.
Ta có: mhhA= 8(g)
<=> mMgO + mCuO= 8
<=> 40x+80y=8 (a)
mHCl= 150.7,3%= 10,95(g) => nHCl= 10,95/36,5= 0,3(mol)
=> nHCl(1) + nHCl(2)= 0,3
<=> 2x+2y=0,3(b)
Từ (a) và (b) nên:
\(\left\{{}\begin{matrix}40x+80y=8\\2x+2y=0,3\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
=> mMgO= 0,1.40=4(g) ; mCuO= 8-4=4(g)
=>%mMgO= (4/8).100= 50% => %mCuO=50%
b) mddB= mhhA+ mddHCl= 8+150=158(g)
mMgCl2= 95x= 95. 0,1= 9,5(g)
mCuCl2=135y=135.0,05=6,75(g)
C%ddMgCl2=(9,5/158).100= 6,013%
C%ddCuCl2= (6,75/158).100 = 4,272%
c) PTHH: (3) MgO + H2SO4 -> MgSO4 + H2O
(4) CuO + H2SO4 -> CuSO4 + H2O
nH2SO4(3+4)= nH2SO4(3) + nH2SO4(4)= nMgO(3) + nCuO(4)= 0,1+0,0,5= 0,15(mol)
=> VddH2SO4= nH2SO4/CMddH2SO4= 0,15/2= 0,075(l)= 75(ml)
=> mddH2SO4= 1,2.75= 90(g)