Trong nguyên tử nguyên tố X tổng số các loại hạt là 46 . Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 14
a. Tính số lượng mỗi loại hạt
b. Cho biết X là nguyên tố gì
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a. Nguyên tử X:
\(\left\{{}\begin{matrix}2P+N=52\\2P-N=16\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}P=17=E=Z\\N=18\end{matrix}\right.\)
Sơ đồ đơn giản:
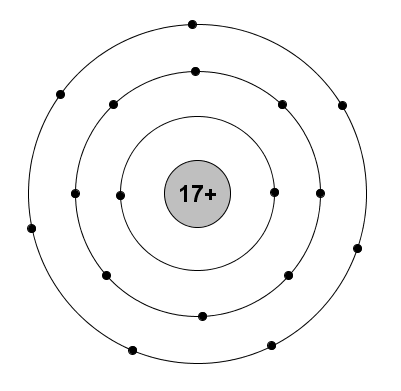
b. * Nguyên tử Y:
\(\left\{{}\begin{matrix}2P+N=28\\N\approx35,7\%.28=10\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}P=E=Z=9\\N=10\end{matrix}\right.\)
Sơ đồ cấu tạo nguyên tử Y:
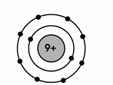
Em tham khảo nha!

Ta có: p + e + n = 52
Mà p = e, nên: 2p + n = 52 (1)
Theo đề, ta có: 2p - n = 16 (2)
Từ (1) và (2), ta có HPT:
\(\left\{{}\begin{matrix}2p+n=52\\2p-n=16\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=17\\n=18\end{matrix}\right.\)
Vậy p = e = 17 hạt, n = 18 hạt.
Vì tổng số hạt proton , nơtron , electron là 52 nên ta có :
\(p+n+e=52\Leftrightarrow2p+n=52\left(1\right)\)
Vì số hạt mang điện nhiều hơn số hạt không mang điện nên ta có :
\(2p-n=16\left(2\right)\)
Từ (1) và (2) ta có hệ phương trình :
\(\left\{{}\begin{matrix}2p+n=52\\2p-n=16\end{matrix}\right.\)
Giải hệ ta được :
\(p=17\Rightarrow e=17\)
\(n=18\)

4.
Ta có: \(\left\{{}\begin{matrix}p+e+n=93\\n-p=6\\p=e\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=29\\n=35\end{matrix}\right.\)
\(\Rightarrow A=p+n=29+35=64\left(u\right)\)
⇒ M là đồng (Cu)
5.
Ta có: \(\left\{{}\begin{matrix}p+e+n=36\\p=e\\p+n-e=12\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=12\\n=12\end{matrix}\right.\)
\(\Rightarrow A=p+n=12+12=24\left(u\right)\)\
⇒ X là magie (Mg)

\(a,\) \(X=p+e+n=34\)
Mà trong 1 nguyên tử, số \(p=e\)
\(\Rightarrow2p+n=34\)
Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 10
\(\Rightarrow2p-n=10\)
\(n=2p-10\)
Trong nguyên tử có:
\(2p+2p-10=34\)
\(4p-10=34\)
\(4p=34+10\)
\(4p=44\)
\(p=44\div4=11\)
\(\Rightarrow p=11,e=11,n=12\)
\(b,\) Nguyên tố x là \(Natri,\) \(KHHH:Na\) \(K.L.N.T=23\)
\(c,\) Nguyên tố x ở ô số 11, ô nguyên tố này cho em biết:
Số hiệu nguyên tử: 11
Tên gọi hh: Sodium (Natri)
KHHH: Na
KLNT: 23 <amu>.
\(d,\) Nguyên tố x nằm ở chu kì 3, nhóm IA.

Gọi :
Số hạt proton = số hạt electron = p
Số hạt notron = n
Ta có :
$2p + n = 93$ và $2p - n = 23$
Suy ra : p = 29 ; n = 35
Vậy A là nguyên tố Cu(Đồng)

\(X(2p; n)\\ X: 2p+n=34(1)\\ MĐ>KMĐ: 2p-n=10(2)\\ (1)(2)\\ p=e=11\\ n=12\\ \Rightarrow Na\)
Ta có: p = e
=> p + e + n = 46 <=> 2p + n = 46(1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 14:
=> 2p - n = 14(2)
Từ (1) và (2) => p = e = 15; n =16
=> X là Photpho.
\(\left\{{}\begin{matrix}2p+n=46\\2p-n=14\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}p=e=15\\n=16\end{matrix}\right.\)
\(p=15\) (P) photpho