Trong giờ thực hành hóa học , hs A cho 32,5 g kẽm vào dung dịch H2SO4 loãng . Học sinh B cho 32,5 g nhôm cũng vài dung dịch H2SO4 loãng ở trên . Hãy cho biết học sinh nào thu đc nhiều khí H2 hơn ? Giải thích ?
Giúp e vs ạ !!! Đề cương hóa khó quá mà e gần thi r

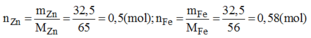
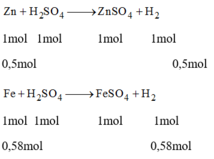
\(PTHH:Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)(1)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)(2)
Ta có: \(m_{Zn}=m_{Al} \)
\(M_{Zn}>M_{Al}\)
\(\Rightarrow n_{Zn}< n_{Al}\)
Mặt khác :
Theo PT(1): \(n_{H_2}=n_{Zn}\)
Theo PT(2):\(n_{H_2}=\frac{3}{2}n_{Al}\)
=> \(n_{H_2\left(pt2\right)}>n_{H_2\left(pt1\right)}\)
=>\(V_{H_2\left(pt2\right)}>V_{H_2\left(pt1\right)}\)
(Đây là cách làm theo lập luận không cần tính nếu bạn muốn chắc chắn thì tìm nZn ; nAl rồi theo PT tính nH2 ; VH2 bình thường cũng ra kết quả như trên .)
Cảm ơn b nhé