Cho 12g hỗn hợp Fe và Cu tác dụng với dung dịch H2SO4 loãng dư thu được 2,24 lít khí ở đktc. Chất rắn còn lại tác dụng với dung dịch H2SO4 đậm đặc nóng dư thu được khí SO2 . Sục hết khí SO2 vào dung dịch nước vôi trong dư thấy xuất hiện a gam kết tủa
a) Viết phương trình
b) Tính phần trăm khối lượng mỗi kim loại hỗn hợp đầu
c) tìm a ??
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Xét thí nghiệm 2: chú ý tính thụ động hóa của kim loại:
H2SO4 đặc, nguội không phản ứng với Al, Cr, Fe!
⇒ trong X chỉ có Cu phran ứng. Bảo toàn electron: n Cu = n SO 2 = 0 , 075 mol.
Đặt n Cr = x mol; n Fe = y mol → m X 52x + 56y + 0,075 × 64 = 18,2 gam.
x + y = 0,25 mol. Giải hệ có: x = 0,15 mol; y = 0,1 mol.
mCr trong X = 42,86% và %mCu trong X = 26,37%
Đáp án A

Chọn đáp án A
Xét thí nghiệm 2: chú ý tính thụ động hóa của kim loại:
H2SO4 đặc, nguội không phản ứng với Al, Cr, Fe!
⇒ trong X chỉ có Cu phran ứng. Bảo toàn electron: n C u = n S O 2 = 0 , 075 m o l
Đặt nCr = x mol; nFe = y mol ⇒ m X = 52x + 56y + 0,075 × 64 = 18,2 gam.
nH2 = x + y = 0,25 mol. Giải hệ có: x = 0,15 mol; y = 0,1 mol.
⇒ % mCr trong X = 42,86% và %mCu trong X = 26,37%

\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\)
\(n_{H_2}=n_{Fe}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
=> \(n_{FeO}=\dfrac{12,8-56.0,1}{72}=0,1\left(mol\right)\)
12,8 g hh X ------> 0,1 mol Fe và 0,1 mol FeO
=> 6,4g hh X ------> 0,05 mol Fe và 0,05 mol FeO
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
2FeO + 4H2SO4 → 4H2O + Fe2(SO4)3 + SO2
=> \(n_{SO_2}=\dfrac{3}{2}n_{Fe}+\dfrac{1}{2}n_{FeO}=0,1\left(mol\right)\)
SO2 + Ca(OH)2→ CaSO3 + H2O
Vì kết tủa nên khối lượng dung dịch giảm : \(m_{thêm}-m_{mất}=0,1.64+0,1.74-0,1.120=1,8\left(g\right)\)
Fe+ H2SO4 -> FeSO4 + H2
0,1___0,1______0,1__0,1(mol)
FeO+ H2SO4-> FeSO4 + H2O
=>mFe= 0,1.56=5,6(g)
=>%mFe=(5,6/12.8).100=43.75%
=>%mFeO=56,25%
6,4gam hh X => Số mol giảm đi 1/2
nFe=0,05(mol)=nCu
PTHH: 2 Fe + 6 H2SO4(đ)-to-> Fe2(SO4)3 + 3 SO2 + 6 H2O
0,05_______0,15__________0,025________0,075(mol)
Cu+ 2 H2SO4(đ) -to-> CuSO4 + SO2 + H2O
0,05___0,1_________0,05____0,05(mol)
=> nSO2=0,125(mol)
PTHH: SO2 + Ca(OH)2 -> CaSO3 + H2O
0,125_______0,125_____0,125(mol)
=> KL dung dịch giảm.
KL giảm:
0,125.64 + 0,125.74 - 0,125.120=2,25(g)
Chúc em học tốt!

Đáp án C.
Kim loại không phản ứng với H2SO4 loãng là Cu.
Gọi nCu = x, nMg = y, nAl = z
Ta có:
64x + 24y + 27z = 33,2 (1)
Bảo toàn e:
2nMg + 3nAl = 2nH2
=> 2y + 3z = 2.1 (2)
2nCu = 2nSO2 => x = 0.2 (mol) (3)
Từ 1, 2, 3 => x = 0,2; y = z = 0,4 (mol)
mCu = 0,2.64 = 12,8 (g)
mMg = 0,4.24 = 9,6 (g)
mAl = 10,8 (g)

Các PTHH :
2Al + 3 H 2 SO 4 → Al 2 SO 4 3 + 3 H 2 (1)
2Al + 6 H 2 SO 4 → Al 2 SO 4 3 + 3 SO 2 + 6 H 2 O (2)
Cu + 2 H 2 SO 4 → Cu SO 4 + 2 H 2 O + SO 2 (3)
Theo PTHH (1) số mol Al tham gia phản ứng bằng 2/3 số mol H 2 => Khối lượng AI trong hỗn hợp : 2×2/3×0,06×27 = 2,16(g)
Số mol SO 2 được giải phóng bởi Al: 2,16/27 x 3/2 = 0,12 mol
Theo PTHH (2) và (3) số mol SO 2 giải phóng bởi Cu : 2.0,1 - 0,12 = 0,08 (mol)
Theo PTHH (3) khối lượng Cu trong hỗn hợp : 0,08. 64 = 5,12 (g)
Vậy m = 2,16 + 5,12 = 7,28 (g).

\(n_{Fe}=a\left(mol\right),n_{FeO}=b\left(mol\right)\)
\(m_X=56a+72b=12.8\left(g\right)\)
\(n_{H_2}=n_{Fe}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(\Rightarrow a=0.1\)
\(b=\dfrac{12.8-56\cdot0.1}{72}=0.1\left(mol\right)\)
\(BTe:\)
\(3n_{Fe}+n_{FeO}=2n_{SO_2}\)
\(\Rightarrow n_{SO_2}=\dfrac{3\cdot0.1+0.1}{2}=0.2\left(mol\right)\)
\(V_{SO_2}=0.2\cdot22.4=4.48\left(l\right)\)
\(\)

P1 :\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: nH2 = nFe = 0,1 mol
P2 :2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O (1)
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O (2)
Ta có: \(\dfrac{3}{2}.0,1\) + nSO2(2) = 0,4 mol
=> x = 0,1 ; y = 0,25 mol
Do chia 2 hỗn hợp X thành phần bằng nhau nên trong gam X có: 0,2 mol Fe và 0,5 mol Cu
=> \(\%m_{Fe}=\dfrac{0,2.56}{0,2.56+0,3.64}.100=36,84\%\)
%m Cu=63,16%
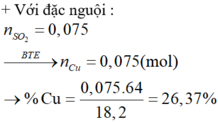

a) Các PTHH:
Thí nghiệm 1: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\left(1\right)\)
Tỉ lệ mol: \(1----------->1\)
Thí nghiệm 2: \(Cu+2H_2SO_4\rightarrow CuSO_4+SO_2+2H_2O\left(2\right)\)
Tỉ lệ mol: \(1------------>1\)
Thí nghiệm 3: \(SO_2+Ca\left(OH\right)_2\left(dư\right)\rightarrow CaSO_3\downarrow+H_2O\left(3\right)\)
Tỉ lệ mol: \(1----------->1\)
b) Theo đề: \(n_{H_2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
Từ (1) \(\Rightarrow n_{Fe}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
\(\Rightarrow\%m_{Fe}=\frac{5,6}{12}.100\%=46,67\%\)
\(\Rightarrow\%m_{Cu}=100\%-46,67\%=53,33\%\)
c) Ta có: \(m_{Cu}=12-5,6=6,4\left(g\right)\Rightarrow n_{Cu}=\frac{6,4}{64}=0,1\left(mol\right)\)
Theo (2), ta có: \(n_{SO_2}=n_{Cu}=0,1\left(mol\right)\)
Theo (3), ta có: \(n_{CaSO_3}=n_{SO_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{CaSO_3}=a=0,1.120=12\left(g\right)\)
j