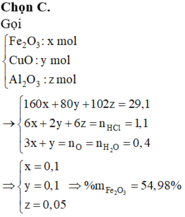Để khử hoàn toàn 18 gam 1 oxit kim loại cần 7,56 lít hỗn hợp hidro và CO . Mặt khác lấy lượng kim loại tạo thành cho tan hoàn toàn trong dd HCL thì thu đk 5,04 lít H2 . Tìm CTHH của oxit kim loại trên biết các khí đo ở đktc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


mKL 1phần = 5g
TN1: td với O2
Bảo toàn kl
⇒mO2=5,32-5=0,32g
⇒mol O2=0,01 mol
⇒V=0,224l
O2+4e→2O2−
−0,01 mol⇒⇒0,04 mol
Mol e nhận=0,04 mol
P2: lượng KL vẫn thế
⇒mol e nhận và nhường ko đổi=0,04 mol
2H++2e→H2
0,04 mol⇐0,04 mol⇒0,02 mol
V'=0,02.22,4=0,448l
Mol HCl=2mol
H2=0,04 mol
⇒mHClmHCl=1,46g
Bảo toàn klg=>m=5+1,46-0,02.2=6,42g

\(Mg\left(x\right)+2HCl\rightarrow MgCl_2+H_2\left(x\right)\)
\(2Al\left(y\right)+6HCl\rightarrow2AlCl_3+3H_2\left(1,5y\right)\)
\(Fe\left(z\right)+2HCl\rightarrow FeCl_2+H_2\left(z\right)\)
\(Mg\left(x\right)+Cl_2\left(x\right)\rightarrow MgCl_2\)
\(2Al\left(y\right)+3Cl_2\left(1,5y\right)\rightarrow2AlCl_3\)
\(2Fe\left(z\right)+3Cl_2\left(1,5z\right)\rightarrow2FeCl_3\)
Gọi số mol của Mg, Al, Fe trong hỗn hợp lần lược là x, y, z ta có
\(24x+27y+56z=26,05\left(1\right)\)
Số mol H2: \(\frac{13,44}{22,4}=0,6\)
\(\Rightarrow x+1,5y+z=0,6\left(2\right)\)
Số mol Cl2 là: \(\frac{17,36}{22,4}=0,775\)
\(\Rightarrow x+1,5y+1,5z=0,775\left(3\right)\)
Từ (1), (2), (3) ta có hệ: \(\left\{\begin{matrix}24x+27y+56z=26,05\\x+1,5y+z=0,6\\x+1,5y+1,5z=0,775\end{matrix}\right.\)
M ra đáp số âm không biết có phải do đề sai không

CuO+CO->Cu+CO2
x x x x
Fe2O3+3CO->2Fe+3CO2
y 3y 2y 3y
nCO=0.04(mol)
Ta có:x+3y=0.04
64x+112y=1.76
x=y=0.01(mol)
->a=0.01*80+0.01*160=2..4(g)
nCO2=0.01+0.01*3=0.04(mol)
V=0.896(l)

Gọi x, y lần lượt là số mol Zn và kim loại A. (x, y > 0)
PT theo khối lượng hỗn hợp:
65x + Ay = 1,7 (I)
Zn + 2HCl → ZnCl2 + H2
x//////2x///////////x///////////x
A + 2HCl → ACl2 + H2
y/////2y//////////y//////////y
nH2 = 0,03 (mol)
=> x + y = 0,03 (II)
nA = 1,9/A
nHCl = 0,1 (mol)
=> 1,9/A < 0,05
=> A > 38 (*)
Từ (I) và (II) có hệ phương trình, biến đổi hệ ta được:
y(65 – A) = 0,25
=> y = 0,25/(65 – A) => A < 65
Vì y < 0,03
=> 0,25/(65 – A) < 0,03
=> A < 56 (*) (*)
Từ (*) và (*) (*) ta có khoảng của A
38 < A < 56
=> A là Ca (40)

Đáp án C
Ta có: nCO = 0,8 mol; = 0,9 mol
Gọi n là hóa trị của kim loại M (1 ≤ n ≤ 3)
Trong phản ứng giữa M với H2SO4 đặc nóng, M là chất khử nhường electron.
H2SO4 đặc là chất oxi hóa nhận electron:

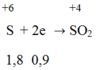
Trong phản ứng khử oxit kim loại bởi CO ta luôn có:
nO (trong oxit) = nCO = 0,8 mol
⇒Tỉ lệ:
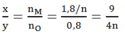
Dựa vào các đáp án ta thấy n = 2 hoặc n = 3


Mg + 2 H2SO4 (đ) -to-> MgSO4 + SO2 + 2 H2O
x_________2x__________________x(mol)
2 Fe + 6 H2SO4(đ) -to-> Fe2(SO4)3 + 3 SO2 + 6 H2O
y______3y_____________________1,5y(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}24x+56y=18,4\\x+1,5y=0,6\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,3\\y=0,2\end{matrix}\right.\)
=> mMg= 0,3.24=7,2(g)
=> %mMg= (7,2/18,4).100=39,13%
=>%mFe= 60,87%
b) nH2SO4(tổng)=2x+3y=2.0,3+3.0,2=1,2(mol)
VddH2SO4=1,2/2=0,6(l)
a) Đặt \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Mg}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow56a+24b=18,4\) (1)
Ta có: \(n_{SO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Bảo toàn electron: \(3a+2b=0,6\cdot2\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,3\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,2\cdot56}{18,4}\cdot100\%\approx60,87\%\\\%m_{Mg}=39,13\%\end{matrix}\right.\)
b) Ta có: \(\left\{{}\begin{matrix}n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe}=0,1\left(mol\right)\\n_{MgSO_4}=n_{Mg}=0,3\left(mol\right)\end{matrix}\right.\)
Bảo toàn nguyên tố: \(n_{H_2SO_4}=n_{SO_2}+3n_{Fe_2\left(SO_4\right)_3}+n_{MgSO_4}=1,2\left(mol\right)\)
\(\Rightarrow V_{H_2SO_4}=\dfrac{1,2}{2}=0,6\left(l\right)=600\left(ml\right)\)