Nhiệt lượng tỏa ra khi đốt cháy hoàn toàn 1 mol khí CH4 là 890kJ, 1 mol C2H2 là 1300 kJ. Cần đốt cháy bao nhiêu lít khí metan để nhiệt lượng tỏa ra cũng bằng với việc đốt cháy 2,5 lít khí axetilen ? Các thể tích khí đo ở cùng điều kiện nhiệt độ, áp suất.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{CH_4} = \dfrac{11,2.90\%}{22,4}= 0,45\ mol\)
Nhiệt lượng tỏa ra :
\(Q = 783.0,45 = 325,35\ KJ/mol\)
Thể tính khí metan CH4 = 11,2.90% = 10,08 lít
=> nCH4 = \(\dfrac{10,08}{22,4}\) = 0,45 mol
1 mol metan khi cháy tỏa ra nhiệt lượng là 783 kj
=> Khi đốt cháy 0,45 mol metan hay 11,2 lít khí bioga thì nhiệt lượng tỏa ra = 783.0,45= 352,35 kj

Số mol của axetilen là :
11,2/22,4 x 20/100 = 0,1 mol
Số mol của etilen là :
11,2/22,4 x 80/100 = 0,4 mol
Vậy nhiệt lượng toả ra khi đốt là
(0,1 x 1320) + (0,4 x 1423) = 701,2 (kJ).


Nhiệt lượng toả ra khi đốt cháy hoàn toàn 1 kg etilen là :
1423/28 x 1000g = 50821,4kJ
Nhiệt lượng toả ra khi đốt cháy hoàn toàn 1 kg axetilen là :
1320/26 x 10006 = 50769,2kJ

\(n_{C_2H_2}=\dfrac{2,5}{22,4}=\dfrac{25}{224}\left(mol\right)\)
nhiệt lượng tỏa ra khi đốt \(\dfrac{25}{244}\) mol C\(_2H_2=\dfrac{25}{224}.1300\approx145\left(kj\right)\)
đốt 1 mol \(CH_4\rightarrow\) 890kj nhiệt
đốt a mol \(CH_4\rightarrow\) 145,1 kj nhiệt
\(\Leftrightarrow a=\dfrac{145}{890}=\dfrac{29}{178}\)(mol)
\(\Rightarrow V_{CH_4}=\dfrac{29}{178}.22,4\approx3,65\left(l\right)\)

1. Trong 1000 m 3 khí thiên nhiên có 850 m 3 C H 4
2 C H 4 → 1500 ° C C 2 H 2 + 3 H 2
CH ≡ CH + HCl → 150 - 200 ° C , H g C l 2 C H 2 = C H - C l
Khối lượng vinyl clorua thu được (nếu hiệu suất các quá trình là 100%) là:
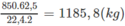
Với hiệu suất cho ở đầu bài, khối lượng vinyl clorua là:
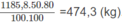
2. Nhiệt lượng cần dùng để làm nóng 100 lít nước từ 20 ° C lên 100 ° C :
100.4,18.(100 - 20) = 33440 (kJ)
Vì 20% nhiệt lượng đã toả ra môi trường nên nhiệt lượng mà khí thiên nhiên cần cung cấp phải là :
Đặt số mol C 2 H 6 tà x thì số mol C H 4 là 85. 10 - 1 x.
Ta có 1560x + 88085. 10 - 1 x = 41800
x = 462. 10 - 2
Thể tích khí thiên nhiên cần dùng:
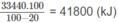

a)
CH4 + 2O2 --to--> CO2 + 2H2O
2C2H6 + 7O2 --to--> 4CO2 + 6H2O
b) \(n_{CH_4}=\dfrac{85\%.112}{22,4}=4,25\left(mol\right)\)
\(n_{C_2H_6}=\dfrac{112.10\%}{22,4}=0,5\left(mol\right)\)
=> \(Q=4,25.880+0,5.1560=4520\left(kJ\right)\)
c) \(Q=2000.4,18.\left(100-20\right)=668800\left(J\right)=668,8\left(kJ\right)\)
Giả sử có a mol khí thiên nhiên
=> \(\left\{{}\begin{matrix}n_{CH_4}=a.85\%=0,85a\left(mol\right)\\n_{C_2H_6}=a.10\%=0,1a\left(mol\right)\end{matrix}\right.\)
\(Q=880.0,85a+1560.0,1a=668,8\left(kJ\right)\)
=> a = \(\dfrac{418}{565}\left(mol\right)\) => \(V=\dfrac{418}{565}.22,4=16,572\left(l\right)\)

1 mol etilen tạo ra 1423kJ
0,2 mol etilen tạo ra 0 , 2 . 1423 1 = 284 , 6 K J
Đáp án: D

CH4 + 2O2 ---to--> CO2 + 2H2O
nCH4 = 4,48 : 22,4 = 0,2 (mol)
--> VO2 = 0,2 x 2 x 22,4 = 8,96 (l)
--> Vkk = 8,96 x 5 = 44,8 (l)
nhá