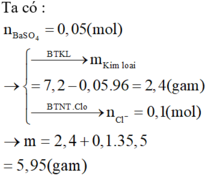
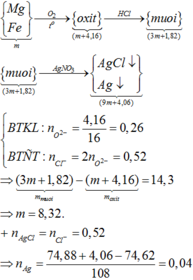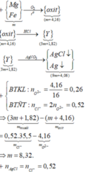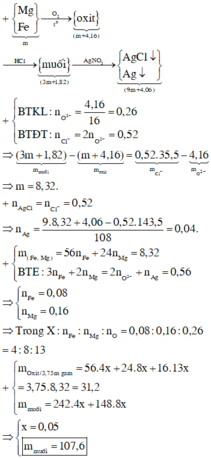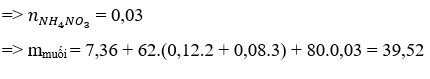Hòa tan một muối kim loại halogen chưa biết hóa trị vào nước để được dung dịch X. Nếu lấy 250ml dung dịch X (chứa 27 gam muối) cho vào AgNO3 dư thì thu được 57,4 gam kết tủa. Mặt khác điện phân 125ml dung dịch X trên thì có 6,4 gam kim lọai bám ở catot. Xác định công thức muối
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Điện phân 125 ml dung dịch X có 6,4 gam kim loại ở catot
Suy ra :
Điện phân 250 ml dung dịch X có \(\dfrac{250.6,4}{125} = 12,8\) gam kim loại ở catot
\(\Rightarrow m_{halogenua} = 27 - 12,8 = 14,2(gam)\\ \Rightarrow m_{Ag(trong\ kết\ tua)} = 57,4 - 14,2 = 43,2\\ \Rightarrow n_{Ag} = \dfrac{43,2}{108} = 0,4(mol)\)
CTHH của kết tủa : AgX
\(\Rightarrow M_{AgX} = 108 + X = \dfrac{57,4}{0,4} = 143,5 \\ \Rightarrow X = 35,5(Cl)\)
X: RCln
\(n_{Cl} = 0,4 \Rightarrow n_{muối} = \dfrac{0,4}{n}(mol)\\ \Rightarrow M_{muối} = R + 35,5n = \dfrac{27}{\dfrac{0,4}{n}} = 67,5n\\ \Rightarrow R = 32n\)
Với n = 1 thì R = 64(Cu)
Vậy muối là CuCl2

Gọi muối là RXn (X ≠≠ F)
\(RXn+nAgNO_3\rightarrow R\left(NO_3\right)_n+nAgX\)
\(n_{AgX}=\frac{57,4}{108+X}\left(mol\right)\)
Mặt khác:
\(2RXn\rightarrow2R+nX_2\)
\(n_R=n_{RXn}=\frac{6,4}{R}\)
Lượng muối điện phân bằng 1/2 lượng muối td AgNO3
\(\rightarrow\frac{12,8}{R}=\frac{57,4}{108n+Xn}\)
\(\Leftrightarrow57,4R=1382,4n+12,8Xn\left(1\right)\)
Mặt khác, m muối= 27g
\(M_{muoi}=\frac{27.\left(108n+Xn\right)}{57,4}\)
\(\Leftrightarrow57,4R+57,4Xn=2916n+27Xn\)
\(\Leftrightarrow30,4Xn+57,4R=2916n\left(2\right)\)
Với n=1; giải hệ (1)(2)\(\rightarrow\) R= 32 (S), X= 35,5 (Cl) (loại)
Tương tự n= 2; 3 không có kết quả (??)