Trộn 100ml HCl 1M vào 150ml dung dịch NaCl 1M. Tính nồng độ mol/lít các ion trong dung dịch thu được. Giúp em với ạ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


PTHH: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{NaOH}=0,2\cdot1=0,2\left(mol\right)\\n_{HCl}=0,1\cdot1=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) NaOH còn dư
\(\Rightarrow\) Dung dịch sau p/ứ có môi trường bazơ
\(\Rightarrow n_{NaCl}=0,1\left(mol\right)=n_{NaOH\left(dư\right)}\) \(\Rightarrow C_{M_{NaCl}}=\dfrac{0,1}{0,2+0,1}\approx0,33\left(M\right)=C_{M_{NaOH\left(dư\right)}}\)

\(n_{CO_3^{2-}}=0,1\left(mol\right);n_{HCO_3^-}=0,2\left(mol\right);n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(CO_3^{2-}+H^+\text{→}HCO_3^-\)
0,1 0,1 0,1 (mol)
\(HCO_3^-+H^+\text{→}CO_2+H_2O\)
0,15 0,15 0,15 (mol)
Suy ra :
\(V=\dfrac{0,1+0,15}{1}=0,25\left(lít\right)\)

Đáp án B
Ta có: nCO2= 0,15 mol; nBa(OH)2= 0,125 mol; nOH-= 0,25 mol
Ta thấy 1 < n OH - n CO 2 = 0 , 25 1 , 5 = 1,67 < 2 à tạo ra 2 muối.
PTPỨ:
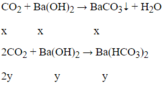
Ta có hệ
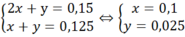
![]()

Câu 6 :
200ml = 0,2l
300ml = 0,3l
\(n_{HCl}=0,15.0,2=0,03\left(mol\right)\)
\(n_{NaOH}=0,12.0,3=0,036\left(mol\right)\)
Pt : \(HCl+NaOH\rightarrow NaCl+H_2O|\)
1 1 1 1
0,03 0,036
Lập tỉ số só sánh : \(\dfrac{0,03}{1}< \dfrac{0,036}{1}\)
⇒ HCl phản ứng hết , NaOH dư
⇒ Tính toán dựa vào số mol của HCl
Khi thêm phenolplatein vào dung dịch NaOH dư thì dung dịch sẽ có màu đỏ
⇒ Chọn câu : D
Chúc bạn học tốt

\(n_{KOH}=0.1\cdot1=0.1\left(mol\right)\)
\(n_{HCl}=0.1\cdot0.5=0.05\left(mol\right)\)
\(KOH+HCl\rightarrow KCl+H_2O\)
\(0.05.......0.05.......0.05\)
Dung dịch D : 0.05 (mol) KOH , 0.05 (mol) KCl
\(\left[K^+\right]=\dfrac{0.05+0.05}{0.1+0.1}=0.5\left(M\right)\)
\(\left[Cl^-\right]=\dfrac{0.05}{0.2}=0.25\left(M\right)\)
\(\left[OH^-\right]=\dfrac{0.05}{0.2}=0.25\left(M\right)\)
\(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
\(0.05.........0.025\)
\(V_{dd_{H_2SO_4}}=\dfrac{0.025}{1}=0.025\left(l\right)\)

Đáp án D
Cho từ từ dung dịch (Na2CO3; NaHCO3) vào dung dịch HCl xảy ra đồng thời các phản ứng (1); (2): (ở đây chú ý tỉ lệ: cứ 1 giọt dung dịch x mol NaHCO3 thì tương ứng chứa 2x mol Na2CO3).
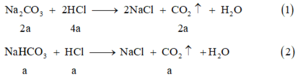
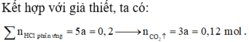
Dung dịch X cho vào dung dịch nước vôi trong dư Ca(OH)2 xảy ra các phản ứng:
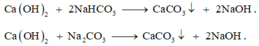
« Nhận xét: Toàn bộ số mol cacbon có trong X đều chuyển hết về kết tủa CaCO3.
Theo đó, bảo toàn nguyên tố cacbon, ta có:
![]()
Theo đó, yêu cầu khối lượng kết tủa thu được là
![]()

[K+]=[Cl-]=0,25M
[KOH dư]=0,25M
b) 2KCl + H2SO4 ----------->K2SO4 + 2HCl
0,05(mol)---->0,025(mol)
=>vH2SO4=\(\frac{0,025}{1}\)=0,025(lít)
c)pH=-log(0,25)=0,602
(câu c mình không chắc chắn lắm nha bạn!!!)
Cho mình hỏi s [K+]=[Cl-]=0,25M đc z. Mình chưa hiểu lắm

\(n_{H^+}=n_{HCl}=0,1.1=0,1\left(mol\right)\\ n_{Na^+}=n_{NaCl}=0,15.1=0,15\left(mol\right)\\ n_{Cl^-}=n_{HCl}+n_{NaCl}=0,1+0,15=0,25\left(mol\right)\\ \left[Na^+\right]=\dfrac{0,15}{0,25}=0,6\left(M\right)\\ \left[H^+\right]=\dfrac{0,1}{0,25}=0,4\left(M\right)\\ n_{Cl^-}=\dfrac{0,25}{0,25}=1\left(M\right)\)