Đốt cháy hoàn toàn 7g hợp chất hữu cơ A thu được 11,2 l khí CO2 đo ở đktc và 9 g nước.
a, Xác định CTHH của A biết tỉ khối dA/CH4=1,75
b, Tính thể tích không khí cần dùng để đốt cháy hoàn toàn a biết oxi chiếm 20% không khí
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

n O 2 = 11,2/32 = 0,35 mol
n C O 2 = 8,8/44 = 0,2 mol ⇒ n C = 0,2 mol
n H 2 O = 5,4/18 = 0,3 mol
⇒ n H = 2.0,3 = 0,6 mol
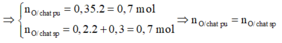
Vậy hợp chất hữu cơ A chỉ có C và H.
Gọi CTTQ của A là C x H y , khi đó ta có:
Vậy CTĐGN của A là C H 3 n
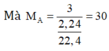
⇒ n = 30/15 = 2
Vậy A là C 2 H 6 .
⇒ Chọn A.

Ta có: \(n_{O_2}=\dfrac{2,856}{22,4}=0,1275\left(mol\right)\)
\(\dfrac{V_{CO_2}}{V_{H_2O}}=\dfrac{4}{3}\Rightarrow\dfrac{n_{CO_2}}{n_{H_2O}}=\dfrac{4}{3}\)
Gọi: nCO2 = 4x (mol) ⇒ nH2O = 3x (mol)
Theo ĐLBT KL, có: mA + mO2 = mCO2 + mH2O
⇒ 2,82 + 0,1275.32 = 4x.44 + 3x.18
⇒ x = 0,03
⇒ nCO2 = 0,03.4 = 0,12 (mol) = nC
nH2O = 0,03.3 = 0,09 (mol) ⇒ nH = 0,09.2 = 0,18 (mol)
Ta có: mC + mH = 0,12.12 + 0,18.1 = 1,62 (g) < 2,82 (g)
→ A chứa C, H và O.
⇒ mO = 2,82 - 1,62 = 1,2 (g) \(\Rightarrow n_O=\dfrac{1,2}{16}=0,075\left(mol\right)\)
Gọi CTPT của A là CxHyOz
⇒ x:y:z = 0,12:0,18:0,075 = 8:12:5
→ CTPT của A có dạng là (C8H12O5)n (n nguyên dương)
Mà: \(M_A< 29.7=203\left(g/mol\right)\)
\(\Rightarrow\left(12.8+12.1+16.5\right)n< 203\)
⇒ n < 1,08 ⇒ n = 1
Vậy: CTPT của A là C8H12O5.

Do đốt cháy A thu được sản phẩm chứa C, H, O
=> Trong A chứa C, H và có thể có O
Gọi \(\left\{{}\begin{matrix}n_{CO_2}=\dfrac{2}{3}a\left(mol\right)\\n_{H_2O}=a\left(mol\right)\end{matrix}\right.\)
\(n_{O_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\)
Theo ĐLBTKL: \(44.\dfrac{2}{3}a+18a=23+1,5.32=71\)
=> a = 1,5 (mol)
=> \(\left\{{}\begin{matrix}n_C=n_{CO_2}=1\left(mol\right)\\n_H=2.n_{H_2O}=3\left(mol\right)\end{matrix}\right.\)
=> \(n_O=\dfrac{23-1.12-3.1}{16}=0,5\left(mol\right)\)
Xét nC : nH : nO = 1 : 3 : 0,5 = 2 : 6 : 1
=> CTPT: (C2H6O)n
Mà MA = 1,4375.32 = 46 (g/mol)
=> n = 1
=> CTPT: C2H6O
\(n_{O_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\\ m_{O_2}=1,5.32=48\left(g\right)\)
Bảo toàn khối lượng: mH2O + mCO2 = mA + mO2 = 23 + 48 = 71 (g)
Ta có:
\(\dfrac{V_{CO_2}}{V_{H_2O}}=\dfrac{2}{3}\Rightarrow\dfrac{n_{CO_2}}{n_{H_2O}}=\dfrac{2}{3}\\ \Rightarrow\dfrac{m_{CO_2}}{m_{H_2O}}=\dfrac{2}{3}.\dfrac{44}{18}=\dfrac{44}{27}\\ \Rightarrow\dfrac{m_{CO_2}}{44}=\dfrac{m_{H_2O}}{27}\)
Theo t/c của dãy tỉ số bằng nhau:
\(\dfrac{m_{CO_2}}{44}=\dfrac{m_{H_2O}}{27}=\dfrac{m_{CO_2}+m_{H_2O}}{44+27}=\dfrac{71}{71}=1\)
=> \(\left\{{}\begin{matrix}m_{CO_2}=1.44=44\left(g\right)\\m_{H_2O}=1.27=27\left(g\right)\end{matrix}\right.\)
Bảo toàn C và H: \(\left\{{}\begin{matrix}n_C=n_{CO_2}=\dfrac{44}{44}=1\left(mol\right)\\n_H=2n_{H_2O}=\dfrac{2.27}{18}=3\left(mol\right)\end{matrix}\right.\)
Bảo toàn O: \(n_O=\dfrac{23-12-3}{16}=0,5\left(mol\right)\)
MA = 1,4375.32 = 46 (g/mol)
CTPT của A có dạng: CxHyOz
=> x : y : z = 1 : 3 : 0,5 = 2 : 6 : 1
=> (C2H6O)n = 46
=> n = 1
=> CTPT của A là C2H6O

a, \(CH_4+2O_2\underrightarrow{t^o}CO_2+H_2O\)
\(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
Ta có: \(n_{CH_4}+n_{C_2H_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\left(1\right)\)
Theo PT: \(n_{CO_2}=n_{CH_4}+2n_{C_2H_2}=\dfrac{56}{22,4}=2,5\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,5\left(mol\right)\\n_{C_2H_2}=1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,5.22,4}{33,6}.100\%\approx33,33\%\\\%V_{C_2H_2}\approx66,67\%\end{matrix}\right.\)
b, Theo PT: \(n_{O_2}=2n_{CH_4}+\dfrac{5}{2}n_{C_2H_2}=3,5\left(mol\right)\Rightarrow m_{O_2}=3,5.32=112\left(g\right)\)

1. Theo định luật bảo toàn khối lượng:
m A = m C O 2 + m H 2 O − m O 2
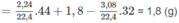
Khối lượng C trong 1,8 g A là: 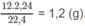
Khối lượng H trong 1,8 g A là: 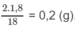
Khối lượng O trong 1,8 g A là : 1,8 - 1,2 - 0,2 = 0,4 (g).
Công thức chất A có dạng C x H y O z :
x : y : z = 0,1 : 0,2 : 0,025 = 4 : 8 : 1
CTĐGN là C 4 H 8 O
2. M A = 2,25.32 = 72 (g/mol)
⇒ CTPT trùng với CTĐGN: C 4 H 8 O .
3. Các hợp chất cacbonyl C 4 H 8 O :
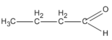 (butanal)
(butanal)
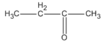
 (2-metylpropanal)
(2-metylpropanal)
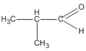
 (butan-2-ol)
(butan-2-ol)

\(a,Đặt:n_{CH_4}=a\left(mol\right);n_{C_4H_{10}}=b\left(mol\right)\left(a,b>0\right)\\ PTHH:CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\\ 2C_4H_{10}+13O_2\rightarrow\left(t^o\right)8CO_2+10H_2O\\ \Rightarrow\left\{{}\begin{matrix}16a+58b=7,4\\22,4a+22,4.4b=22\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}m_{CH_4}=0,1.16=1,6\left(g\right)\\m_{C_4H_{10}}=0,1.58=5,8\left(g\right)\end{matrix}\right.\\ b,n_{O_2}=2a+\dfrac{13}{2}b=2.0,1+6,5.0,1=0,85\left(mol\right)\\ \Rightarrow V_{O_2\left(đktc\right)}=0,85.22,4=19,04\left(l\right)\)