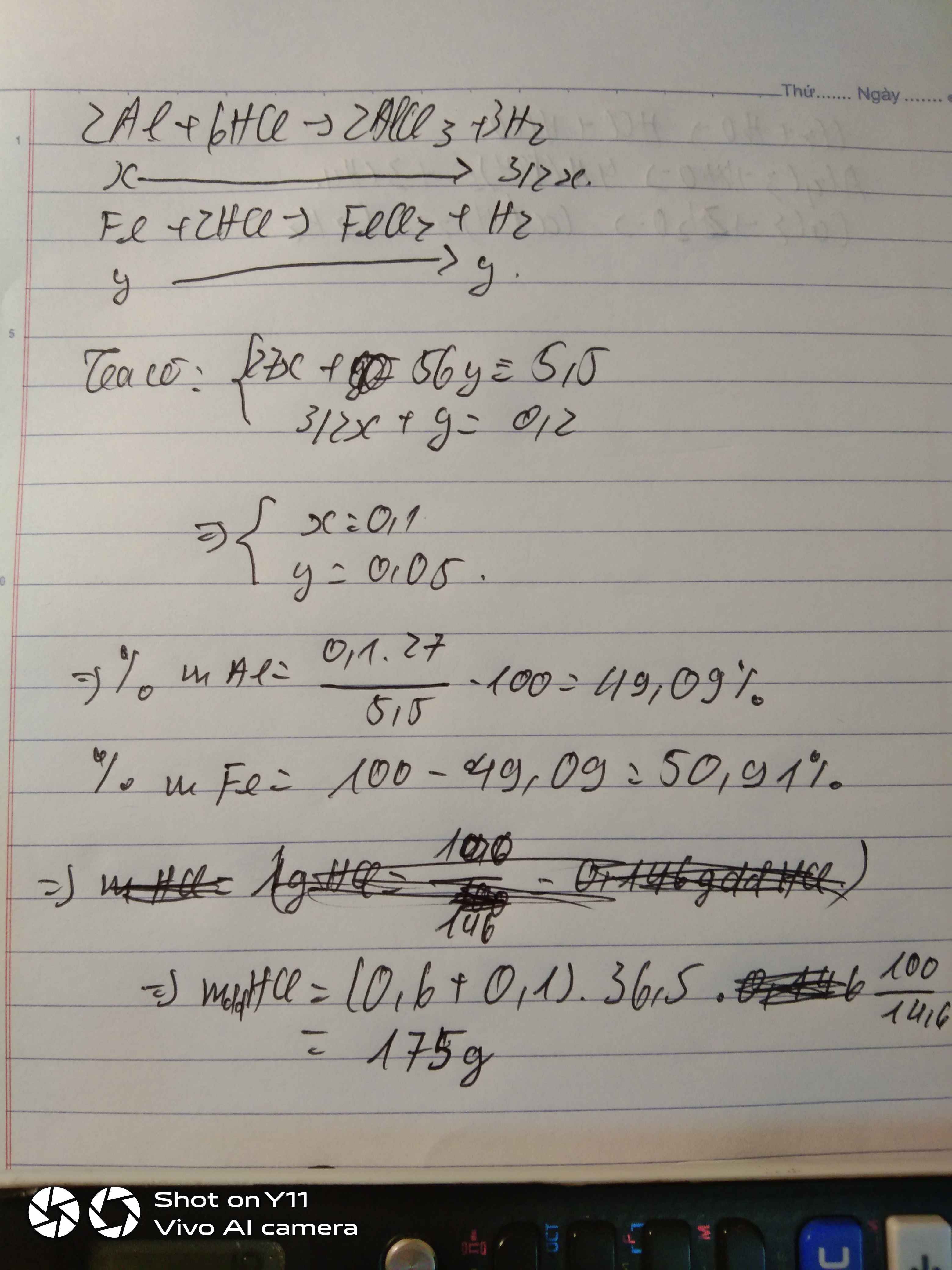Hòa tan hoàn toàn 2,7 gam kim loại Aluminum Al bằng một lượng vừa đủ dung dịch hydrochloric acid HCl 14,6% thu được V lit khí hydrogen (đkc). a. Tính V. b. Tính khối lượng dung dịch HCl 14,6% cần dùng. c. Tính nồng độ phần trăm của dung dịch muối sau phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
_____0,2____0,4___________0,2 (mol)
\(\Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\)
b, \(V_{H_2}=0,2.24,79=4,958\left(l\right)\)
c, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
____________0,2__2/15 (mol)
\(\Rightarrow m_{Fe}=\dfrac{2}{15}.56=\dfrac{112}{15}\left(g\right)\)
Số mol của 13 gam Zn:
\(n_{Zn}=\dfrac{m}{M}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
1 : 2 : 1 : 1 (g)
0,2\(\rightarrow\) 0,4 : 0,2 : 0,2 (mol)
a,Khối lượng của 0,4 mol HCl:
\(m_{HCl}=n.M=0,4.36,5=14,6\left(g\right)\)
b, Thể tích khí H2:
\(V_{H_2}=n.24,79=0,2.24,79=4,958\left(l\right)\)
\(3H_2+Fe_2O_3\underrightarrow{t^o}2Fe+3H_2O\)
Khối lượng của \(\dfrac{2}{15}\) mol Fe:
\(n_{Fe}=\dfrac{m}{M}=\dfrac{2}{\dfrac{15}{56}}\approx7,5\left(g\right)\)

Gọi \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo pt: \(\Rightarrow\left\{{}\begin{matrix}3x+y=0,2\\27x+56y=5,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=\dfrac{19}{470}\\y=\dfrac{37}{470}\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{\dfrac{19}{470}\cdot27}{5,5}\cdot100\%=19,84\%\)
\(\%m_{Fe}=100\%-19,84\%=80,16\%\)

Gọi KL là R
\(n_{H_2}=\dfrac{13,44}{22,4}=0,6(mol)\\ a,2R+6HCl\to 2RCl_3+3H_2\\ \Rightarrow n_R=0,4(mol)\\ \Rightarrow M_R=\dfrac{10,8}{0,4}=27(g/mol)(Al)\\ b,n_{HCl}=1,2(mol)\\ \Rightarrow m_{dd_{HCl}}=\dfrac{1,2.36,5}{14,6\%}=300(g)\)

Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
a. PTHH: \(Mg+2HCl--->MgCl_2+H_2\)
Theo PT: \(n_{Mg}=n_{H_2}=0,2\left(mol\right)\)
=> \(m_{Mg}=0,2.24=4,8\left(g\right)\)
Theo PT: \(n_{HCl}=2.n_{Mg}=2.0,2=0,4\left(mol\right)\)
=> \(m_{HCl}=0,4.36.5=14,6\left(g\right)\)
=> \(C_{\%_{HCl}}=\dfrac{14,6}{200}.100\%=7,3\%\)
b. Ta có: \(m_{dd_{MgCl_2}}=4,8+200=204,8\left(g\right)\)
Theo PT: \(n_{MgCl_2}=n_{Mg}=0,2\left(mol\right)\)
=> \(m_{MgCl_2}=0,2.95=19\left(g\right)\)
=> \(C_{\%_{MgCl_2}}=\dfrac{19}{204,8}.100\%=9,28\%\)

1) \(n_{HCl}=\dfrac{80.14,6\%}{36,5}=0,32\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,16<-0,32--->0,16--->0,16
a = 0,16.65 = 10,4 (g)
2) V = 0,16.22,4 = 3,584 (l)
3) mdd sau pư = 10,4 + 80 - 0,16.2 = 90,08 (g)
\(C\%_{ZnCl_2}=\dfrac{0,16.136}{90,08}.100\%=24,156\%\)

\(n_{Al}=a\left(mol\right),n_{Fe}=b\left(mol\right)\)
\(m_X=27a+56b=11\left(g\right)\left(1\right)\)
\(n_{H_2}=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\Rightarrow a+1.5b=0.4\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.2\)
\(n_{HCl}=2n_{H_2}=2\cdot0.4=0.8\left(mol\right)\)
\(m_{dd_{HCl}}=\dfrac{0.8\cdot36.5\cdot100}{14.6}=200\left(g\right)\)
\(\%Fe=\dfrac{0.1\cdot56}{11}\cdot100\%=50.91\%\)
\(\%Al=49.09\%\)