Đốt cháy hoàn toàn 7.4g hỗn hợp 2 este đồng phân, ta thu được 6.72l CO2 (dkc) và 5.4g H2O. Vậy CTCT của 2 este là ? A. CH3COOCH3 và HCOOCH2CH3 B. CH2=CHCOOCH3 và HCOOCH2CH=CH2 C. CH3CH2COOCH3 và CH3COOCH2CH2 D. CH3COOH=CH2 và CH2=CHCOOCH3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
Giải:
nCO2=0,08 ; nH2O=0,08 => nO = (1,76-0,08.12+0,08.2)/16=0,04 =>CTPT của 2 este là C4H8O2

Đáp án: A
Vì V CO2 = V H2O => Este no, mạch hở, đơn chức
nNaOH = 0,03 mol => M este = 22 , 2 0 , 3 = 74 (C3H6O2)
Do đó, hai este là CH3COOCH3 và HCOOC2H5
Khi đốt 0,03 mol C3H6O2, tạo nCO2 = nH2O = 0,09 mol
=> mCO2 + mH2O = 5,58 g

Đáp án : D
Giả sử mỗi este có độ bất bão hòa là k
nCO2 = 0,37 mol , nH2O = 0,29 mol
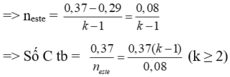
Dễ thấy, với k ≥ 3 => C trung bình ≥ 9,25 , không có đáp án
=> k = 2 , C trung bình = 4,625 => Este là C4H6O2 và C5H8O2

Đáp án A
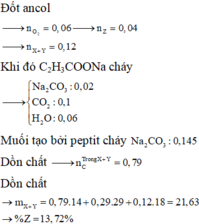
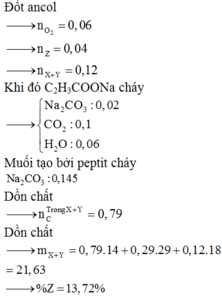
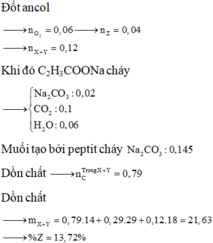
Đốt ancol
![]()
![]()
Khi đó C2H3COONa cháy

Muối tạo bởi peptit cháy
![]()
Dồn chất
![]()
Dồn chất
![]()
![]()
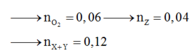



\(n_{CO_2}=n_{H_2O}=0,3\left(mol\right)\\ \Rightarrow Este.no.đơn.hở:C_nH_{2n}O_2\\ m_{O\left(este\right)}=7,4-\left(0,3.12+0,3.2.1\right)=3,2\left(g\right)\\ \Rightarrow n_{O\left(este\right)}=\dfrac{3,2}{16}=0,2\left(mol\right)\\ n_{O_2}=\dfrac{0,3.2+0,3-0,2}{2}=0,35\left(mol\right)\\ C_nH_{2n}O_2+\dfrac{3n-2}{2}O_2\underrightarrow{^{to}}nCO_2+nH_2O\\ \Rightarrow\dfrac{n}{0,3}=\dfrac{\dfrac{3n-2}{2}}{0,35}\\ \Leftrightarrow n=3\\ \Rightarrow CTPT:C_3H_6O_2\\ \Rightarrow A\)