Từ 80 tấn quặng FeS2 chứa 40% lưu huỳnh sản xuất được 92 tấn H2SO4
a) tính hiệu suất của quá trình
b) từ 92 tấn H2SO4 có thể pha chế thành bao nhiêu tấn dd H2SO4
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đổi 1,2 tấn = 1200 kg
Ta có: \(n_{FeS_2}=\dfrac{1200}{120}=10\left(kmol\right)\)
Bảo toàn Lưu huỳnh: \(n_{H_2SO_4\left(lý.thuyết\right)}=2n_{FeS_2}=20\left(kmol\right)\)
\(\Rightarrow m_{ddH_2SO_4\left(thực\right)}=\dfrac{20\cdot98}{50\%}\cdot80\%=3136\left(kg\right)=3,136\left(tấn\right)\)

Đáp án C.
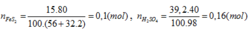
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%

Đề có phải là : ' Từ 80 tấn quặng Pirit chứa 40% lưu huỳnh , người ta sản xuất được 73,5 tấn axit sunfuric . '' đúng không
FeS2+8HNO3→2H2O+2H2SO4+5NO+Fe(NO3)3
a) khối lượng S trong quặng pirit:
mS=80*40%=32(tấn)
khối lượng S trong H2SO4
m=92:98*32=30(tấn)
H=\(\frac{30}{32}\cdot100\%\)=93,75%
b) C%=\(\frac{m_{ct}}{m_{dd}}\cdot100\%\) =???(thiếu đề thì phải bạn xem lại )