Tính số mol của các lượng chất sau a) 4,6 gam Na;8,4 gam KOH ;11,76gam H3PO4; 16gam khí oxi b) 2,24 lít khí C2H4; 3,36 lít khí CO2; 10,08 lít khí N2 . Các thể tích đó ở điều kiện tiêu chuẩn
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Na}=\dfrac{4,6}{23}=0,2mol\)
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(4Na+O_2\underrightarrow{t^o}2Na_2O\)
0,2 0,3 0
0,2 0,05 0,1
0 0,25 0,1
Chất dư: \(O_2\) và có \(m_{O_2dư}=0,25\cdot32=8g\)
\(m_{Na_2O}=0,1\cdot62=6,2g\)
\(n_{Na}=\dfrac{m_{Na}}{M_{Na}}=\dfrac{4,6}{23}=0,2mol\)
\(n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{6,72}{22,4}=0,3mol\)
\(4Na+O_2\rightarrow2Na_2O\)
0,2 < 0,3 ( mol )
0,2 0,05 0,1 ( mol )
Chất còn dư là O2
\(m_{O_2\left(dư\right)}=n_{O_2\left(dư\right)}.M_{O_2\left(dư\right)}=\left(0,3-0,05\right).32=8g\)
\(m_{Na_2O}=n_{Na_2O}.M_{Na_2O}=0,1.62=6,2g\)

\(n_{Na}=\dfrac{4.6}{23}=0.2\left(mol\right)\)
\(n_{O_2}=\dfrac{0.448}{22.4}=0.02\left(mol\right)\)
\(4Na+O_2\underrightarrow{^{^{t^0}}}2Na_2O\)
\(4..........1\)
\(0.2.....0.02\)
\(LTL:\dfrac{0.2}{4}>\dfrac{0.02}{1}\Rightarrow Nadư\)
\(m_{Na\left(dư\right)}=\left(0.2-0.08\right)\cdot23=2.76\left(g\right)\)
\(m_{Na_2O}=0.04\cdot62=2.48\left(g\right)\)

Công thức:
Tính số mol khí khi biết thể tích khí ở điều kiện tiêu chuẩn: n = 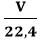
Tính thể tích khí ở điều kiện tiêu chuẩn khi biết số mol: V = n.22,4 (lít)
Trong đó:
+ n: số mol khí (mol)
+ V: thể tích khí ở đktc (lít) công thức
\(n_{H_2}=\dfrac{4}{2}=2\left(mol\right)\)
\(n_{CuSO_4}=\dfrac{8}{160}=0,05\left(mol\right)\)
\(n_{SO_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\)
\(n_{Na}=\dfrac{3,6.10^{23}}{6.10^{23}}=0,6\left(mol\right)\)

a) nNa = 4,6/23 = 0,2 (mol)
PTHH: 2Na + 2H2O -> 2NaOH + H2
Mol: 0,2 ---> 0,2 ---> 0,2 ---> 0,1
VH2 = 0,1 . 22,4 = 2,24 (l)
b) CMNaOH = 0,2/0,1 = 2M
c) mH2O = 100 . 1 = 100 (g)
mNaOH = 0,2 . 40 = 8 (g)
mH2 = 0,1 . 2 = 0,2 (g)
mdd = 100 + 8 - 0,2 = 107,8 (g)
C%NaOH = 8/107,8 = 7,42%

2Na + 2HCl → 2NaCl + H2
x---------------------x
2Na + 2H2O → 2NaOH + H2
y----------------------y
Ta có: x + y = 0,2 và 58,5x + 40y = 9,85 → x = y = 0,1 mol → [HCl] = 1M

\(2Na+2H_2O\rightarrow2NaOH+H_2\\ n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\\ n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\\ LTL:\dfrac{0,2}{2}>\dfrac{0,1}{2}\\ \Rightarrow Nadư\\ n_{Na\left(pứ\right)}=n_{H_2O}=0,1\left(mol\right)\\ n_{Na\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\\ \Rightarrow m_{Na}=0,1.23=2,3\left(g\right)\\ n_{H_2}=\dfrac{1}{2}n_{H_2O}=0,05\left(mol\right)\\ \Rightarrow V_{H_2}=0,05.22,4=1,12\left(l\right)\)

\(a.n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\\ n_{KOH}=\dfrac{8,4}{56}=0,15\left(mol\right)\\ n_{H_3PO_4}=\dfrac{11,76}{98}=0,12\left(mol\right)\\ n_{O_2}=\dfrac{16}{32}=0,5\left(mol\right)\\ b.n_{C_2H_4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ n_{N_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)