Cho 26g Zn tác dụng vừa đủ với m gam dd HNO3 10% thu được 8,96 lít hỗn hợp khí NO và NO2 (đkc). a. Tính m. b. Tính nồng độ % của muối trong dung dịch sau phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi số mol Zn là a (mol)
\(n_{NO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\); \(n_{NO}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(Zn^0-2e\rightarrow Zn^{+2}\)
a----->2a________________(mol)
\(N^{+5}+1e\rightarrow N^{+4}\)
_____0,3<---0,3___________(mol)
\(N^{+5}+3e\rightarrow N^{+2}\)
_____0,3<---0,1___________(mol)
THEO ĐLBT e: 2a = 0,6
=> a = 0,3 (Mol)
=> m = 0,3.65 = 19,5(g)

Ta có thể viết 2 phản ứng:
Fe+6HNO3 ⇒ Fe(NO3)3 +3NO2 +3H2O
Cu+4HNO3 ⇒ Cu(NO3)2 +2NO2 +2H2O
Có
![]()
Quan sát các phản ứng nhận thấy:
![]()
![]()
Dung dịch A thu được chứa Fe(NO3)3 và Cu(NO3)2.
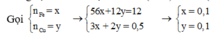
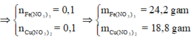
Áp dụng định luật bảo toàn khối lượng ta có:
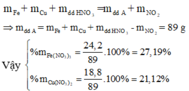
Đáp án B.

gọi a và b lần lượt là n(Fe) và n(Cu)
theo bài ra: 56a + 64b = 12 (I)
ptpư:
Fe + 6HNO3 = Fe(NO3)3 + 3NO2 + 3H2O (1)
a#####6a#######a########3a
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O (2)
b#####4b########b#######2b
theo (1) và (2): n(NO2) = 3a + 2b = 11,2/22,4 = 0,5 mol (II)
giải hệ (I) (II) => a = b = 0,1 mol
=> dung dich A gồm: Fe(NO3)3 (0,1 mol) và Cu(NO3)2 (0,1 mol)
theo (1) (2) thì : n(HNO3) = 6a + 4b = 1 mol
=> khối lượng dung dich HNO3 ban đầu là:
m = (63*1) * 100/63 = 100 (g)
gọi m1 là khối lượng dung dịch sau pư thì:
m1 = m + m(Fe,Cu) - m(NO2) = 100 + 12 - (46*0,5) = 89 (g)
m(Fe(NO3)3) = 242*0,1 = 24,2 (g)
=> C%(Fe(NO3)3) = (24,2/89)*100% = 27,2%
m(Cu(NO3)2) = 188*0,1 = 18,8 (g)
=> C%(Cu(NO3)2) = (18,8/89)*100% = 21,12%.

a)
Gọi $n_{Zn} = a(mol) ; n_{Al} = b(mol) \Rightarrow 65a + 27b = 11,9(1)$
$Zn + 2HCl \to ZnCl_2 + H_2$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
Theo PTHH :
$n_{H_2} = a + 1,5b = \dfrac{8,96}{22,4} = 0,4(2)$
Từ (1)(2) suy ra : a = 0,1; b = 0,2
$m_{Zn} = 0,1.65 = 6,5(gam)$
$m_{Al} = 0,2.27 = 5,4(gam)$
b) $n_{HCl} = 2n_{H_2} = 0,8(mol)$
$C\%_{HCl} = \dfrac{0,8.36,5}{125}.100\% = 23,36\%$

Bài 1 :
PTHH : Zn + H2SO4 ------> ZnSO4 + H2
\(n_{Zn}=\frac{m}{M}=\frac{26}{65}=0,4\left(mol\right)\)
Theo PTHH : nH2 = nZn = 0,4 mol
=> Khối lượng H2 được tạo ra ở đktc là :
\(V=n\times22,4\)
\(\Rightarrow V_{H_2}=0,4\times22,4\)
\(\Rightarrow V_{H_2}=8,96\left(l\right)\)
Theo PTHH : nZnSO4 = nZn = 0,4 mol
=> Khối lượng muối được tạo thành là :
\(m=n\times M\)
\(\Rightarrow m_{ZnSO_4}=0,4\times161\)
\(\Rightarrow m_{ZnSO_4}=64,4\left(g\right)\)
b) Theo PT : \(n_{H_2SO_4}=n_{Zn}=0,4\left(mol\right)\)
=> Khối lượng \(H_2SO_4\)cần dùng cho phản ứng là :
\(m=n\times M\)
\(\Rightarrow m_{H_2SO_4}=0,4\times98\)
\(\Rightarrow m_{H_2SO_4}=39,2\left(g\right)\)
c) Nồng độ phần trăm thu được sau phản ứng là :
\(C\%=\frac{m_{ct}}{m_{dd}}\times100\%\)
\(\Rightarrow C\%=\frac{39,2}{64,4}\times100\%\approx60,9\%\)
Vậy :.........................



a,\(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\);\(n_{hhNO;NO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: 3Zn + 8HNO3 → 3Zn(NO3)2 + 2NO + 4H2O
Mol: x 2/3x
PTHH: Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O
Mol: y 2y
Ta có: \(\left\{{}\begin{matrix}x+y=0,4\\\dfrac{2}{3}x+2y=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,3\\y=0,1\end{matrix}\right.\)
PTHH: 3Zn + 8HNO3 → 3Zn(NO3)2 + 2NO + 4H2O
Mol: 0,3 0,8 0,3 0,2
PTHH: Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O
Mol: 0,1 0,4 0,1 0,2
\(m_{HNO_3}=\left(0,8+0,4\right).63=75,6\left(g\right)\)
\(\Rightarrow m_{ddHNO_3}=\dfrac{75,6.100}{10}=756\left(g\right)\)
b,mdd sau pứ = 26+756-0,2.30-0,2.46 = 766,8 (g)
\(C\%_{ddZn\left(NO_3\right)_2}=\dfrac{\left(0,3+0,1\right).189.100\%}{766,8}=9,86\%\)