1, Cho sản phẩm thu được khi oxi hoá hoàn toàn \(5,6l\) khí sunfurơ (đktc) vào trong 57,2 ml dung dịch \(H_2SO_4\) 60% (D=1,5g/ml). Tính nồng độ phần trăm của dung dịch axit thu được .
2.A là dung dịch \(HCl\) 0,3M, B là dung dịch HCl 0,6M. Trộn A với B theo tỉ lệ \(V_A:V_B=2:3\)thu được dung dịch C . Tính nồng độ mol dung dịch C.

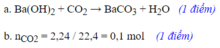
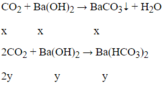
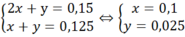
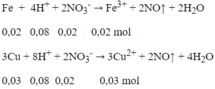
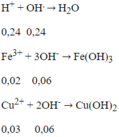
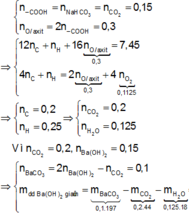
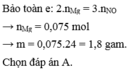
1,
+nSO2 = 5,6/22,4 = 0,25 mol
+mddH2S04 = 57,2 * 1,5 = 85,8g
-> mH2SO4 = 85,8 * 60% = 51,48g
PT
SO2 + 1/2O2 -> SO3
0,25__________0,25 (mol)
mSO3 = 0,25 * 80 = 20g
PT
SO3 + H2O -> H2SO4
0,25___________0,25 (mol)
-> mH2O4 thu được = 0,25 * 98 = 24,5 g
mH2SO4 (dd sau) = mH2SO4 (dd đầu) + mH2SO4 (thu được) = 24,5 + 51,48 = 75,98 g
m dd sau = mSO3 + mdd H2SO4 đầu = 85,8 + 20 = 105,8 g
-> C% dd sau = 75,98/ 105,8 *100% = 71,81%
2, áp dụng sơ đồ đường chéo, ta có
VA -> 0,3 0,6- C
\ /
C
/ \
VB -> 0,6 C – 0,3
mà ta có
VA : VB = 2:3
-> VA/VB = (0,6 - C)/ ( C- 0,3)
giải PT ta được C = 0,48
Vậy nồng độ dung dịch C là 0,48M