Cho kim loại Sắt tác dụng vừa đủ với dung dịch Axit sunfuric loãng H2SO4 có nồng độ 24,5% thu được 11,2 lít khí Hidro ( đo ở đktc )
a) Viết phương trình hóa học xảy ra
b) Tính khối lượng kim loại Sắt đã phản ứng
c) Tính khối lượng dung dịch axit sunfuric H2SO4 24,5% đã tham gia phản ứng ?
d) Tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng ?

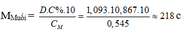
+n H2 = 11,2 / 22,4 = 0,5 mol
PT
Fe + H2SO4 -> FeSO4 + H2
0,5__0,5_____0,5______0,5 (mol)
-> mFe phản ứng = 0,5 * 65 = 28 (g)
gọi mdd H2SO4 = x (g)
-> mH2SO4 (dd đầu) = x*24,5%=0,245x (g)
->nH2S04 (dd đầu) = 0,245x /98 = 0,0025x mol
Theo PT nH2SO4 phản ứng = nH2 = 0,5 mol
-> m dd H2SO4 phản ứng = m H2S04 (dd đầu) phản ứng = 0,5 * 98 = 49 (g)
-> x = 0,5/ 0,0025= 200 (g)
m muối FeSO4 = 0,5 * 152 = 76 g
m H2 = 0,5 *2 = 1 (g)
m dd sau = m Fe + m dd H2SO4 - m H2
= 28 + 200 -1=227 g
C% FeSO4 (ddsau) = 76/227 *100% = 33,48%