1) Cho biết khối lượng mol của một oxit của kim loại là 160 g/mol, thành phần về khối lượng của kim loại trong oxit đó là 70%. Lập công thức hóa học của oxit. Gọi tên oxit đó.
2) Nhôm oxit tác dụng với axit sunfuric theo phương trình hóa học như sau:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Tính khối lượng muối nhôm sunfat được tạo thành nếu đã sử dụng 49 gam axit sunfuric nguyên chất tác dụng với 60 gam nhôm oxit. Sau phản ứng, chất nào còn dư? Khối lượng dư của chất đó là bao nhiêu?

Bài 1:
Gọi CTHH của oxit là \(A_xO_y\) ( x,y là những số nguyên dương đơn giản )
Vì \(M_{A_xO_y}=160\left(g/mol\right)\)
\(\Rightarrow x.M_A+16y=160\left(g/mol\right)\)
\(\%m_A=70\%\Rightarrow\dfrac{x.M_A}{160}.100\%=70\%\)
\(\Rightarrow x.M_A=112\)
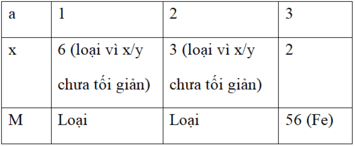
Ta có bảng thử các giá trị của x:
⇒ x = 2 ; MA = 56 ⇒ Kim loại là Fe
\(y=\dfrac{160-112}{16}=3\)
Vậy CTHH : \(Fe_2O_3\)
Bài 2:
\(n_{H_2SO_4}=\dfrac{49}{98}=0,5\left(mol\right)\)
\(n_{Al_2O_3}=\dfrac{60}{102}=0,59\left(mol\right)\)
PTHH: Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Tỉ lệ : \(\dfrac{0,59}{1}>\dfrac{0,5}{3}\)
→ Nhôm oxit dư, tính theo H2SO4
Theo PTHH : \(n_{Al_2O_3}=\dfrac{1}{3}.n_{H_2SO_4}=\dfrac{1}{3}.0,5=\dfrac{1}{6}\left(mol\right)\)
\(\Rightarrow m_{Al_2O_3p/ư}=\dfrac{1}{6}.102=17\left(g\right)\)
\(\Rightarrow m_{Al_2O_3dư}=60-17=43\left(g\right)\)
Theo PTHH: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{3}.n_{H_2SO_4}=\dfrac{1}{3}.0,5=\dfrac{1}{6}\left(mol\right)\)
\(\Rightarrow m_{AL_2\left(SO_4\right)_3}=\dfrac{1}{6}.342=57\left(g\right)\)