Hòa tan 8,8g hỗn hợp gồm bột sắt và bột đồng bằng lượng dư dung dịch H2SO4 loãng thu đc 2,24 lit khí sinh ra (đktc) và chất rắn X
a) Tính % (m) các kim loại có trong hỗn hợp
b) hòa tan hoàn tan chất rắn X bằng H2SO4 đặc, thì thu đc bao nhiu lit khí bay ra (đktc)?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Fe + H2SO4 → FeSO4 + H2
Mol: 0,1 0,1
\(\%m_{Fe}=\dfrac{0,1.56.100\%}{8,8}=63,64\%;\%m_{Cu}=100-63,64=36,36\%\)
Chất rắn X là Cu (Cu ko tác dụng với H2SO4 loãng)
b,\(n_{Cu}=\dfrac{8,8-5,6}{64}=0,05\left(mol\right)\)
PTHH: Cu + 2H2SO4 (đ) → CuSO4 + SO2 + 2H2O
Mol: 0,05 0,05
\(\Rightarrow V_{SO_2}=0,05.22,4=1,12\left(l\right)\)

Đặt nZn = x mol; nFe = y mol.
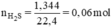
Ta có hệ phương trình: 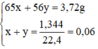
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
Phương trình hóa học của phản ứng:
Zn + S → ZnS
Fe + S → FeS
ZnS + H2SO4 → ZnSO4 + H2S
FeS + H2SO4 → H2S + FeSO4

Fe + S -----> FeS
FeS + 2 HCl ----> FeCl2 + H2S
Fe + 2HCl ----> FeCl2 + H2
a) n(Fe) = 5,6 : 56 = 0,1 ( mol)
n ( S ) = 1,5 : 32 = 0,05 ( mol )
=> sau phản ứng thứ nhất : n(Fe) dư = 0,1 - 0,05 = 0,05 mol ; n(FeS) =n (S ) = 0,05 ( mol)
a) Các chất rắn trong B là: Fe và FeS
Các chất trong dung dịch A là : FeCl2 và HCl dư
b) n(H2 S) = n ( FeS ) = 0,05 ( mol) => V( H2S) = 0,05 x 22,4 = 1,12 ( lit)
n (H2 ) = n(Fe dư) = 0,05 ( mol ) => V( H2) = 1,12 ( lit)

Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH:
\(Fe+H_2SO_4--->FeSO_4+H_2\uparrow\left(1\right)\)
\(Cu+H_2SO_4--\times-->\)
Theo PT(1): \(n_{Fe}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=m_{Cu}=0,1.56=5,6\left(g\right)\)
PTHH: \(Cu+2H_2SO_{4_{đặc}}\overset{t^o}{--->}CuSO_4+SO_2\uparrow+2H_2O\left(2\right)\)
Ta có: \(n_{Cu}=\dfrac{5,6}{64}=0,0875\left(mol\right)\)
Theo PT(2): \(n_{SO_2}=n_{Cu}=0,0875\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,0875.22,4=1,96\left(lít\right)\)

Chất rắn ko tan là Cu
Đặt \(n_{Mg}=x(mol);n_{Al}=y(mol)\Rightarrow 24x+27y=13-4=9(1)\)
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45(mol)\\ PTHH:Mg+2HCl\to MgCl_2+H_2\\ 2Al+6HCl\to 2AlCl_3+3H_2\\ \Rightarrow x+1,5y=0,45(2)\\ (1)(2)\Rightarrow x=0,15(mol);y=0,2(mol)\\ a,\%_{Cu}=\dfrac{4}{13}.100\%=30,77\%\\ \%_{Mg}=\dfrac{0,15.24}{13}.100\%=27,69\%\\ \%_{Al}=100\%-30,77\%-27,69\%=41,54\%\\ b,\Sigma n_{HCl}=2x+3y=0,9(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,9}{2}=0,45(l)\)
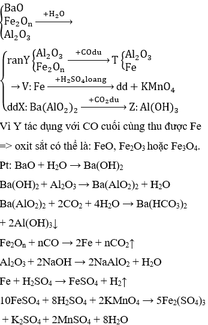
Cu không tác dụng với dung dịch H2SO4 loãng
\(n_{H2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,1 0,1
a) \(n_{Fe}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(m_{Fe}=0,1.56=5,6\left(g\right)\)
\(m_{Cu}=8,8-5,6=3,2\left(g\right)\)
0/0Fe = \(\dfrac{5,6.100}{8,8}=63,64\)0/0
0/0Cu = \(\dfrac{3,2.100}{8,8}=36,36\)0/0
b) Có : \(m_{Cu}=3,2\left(g\right)\)
\(n_{Cu}=\dfrac{3,2}{64}=0,05\left(mol\right)\)
Pt : \(Cu+2H_2SO_{4đặc,nóng}\rightarrow CuSO_4+SO_2+2H_2O|\)
1 2 1 1 2
\(n_{SO2}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
\(V_{SO2\left(dktc\right)}=0,05.22,4=1,12\left(l\right)\)
Chúc bạn học tốt