Khi điện phân dung dịch H2SO4 với điện cực bằng graphit, thì ta thu được khí oxi bay ra. Có thể dùng công thức Fa-ra-đây để tìm khối lượng oxi bay ra được không?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khi điện phân dung dịch H2SO4 với điện cực bằng graphit, ta thu được khí oxi bay ra. Trong trường hợp đó có thể dùng công thức Fa-ra-đây để tính khối lượng oxi bay ra.
Công thức: 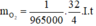

Chọn C
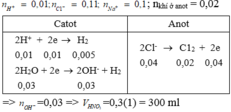
n(MgO) = 0,02; n(khí) = 0,02
Dung dịch sau điện phân có thể hòa tan MgO → có H2SO4
PTHH:
CuSO4 + 2KCl → Cu + Cl2 + K2SO4 1
x---------------------------- x mol
CuSO4 + H2O → Cu + H2SO4 + ½ O2 2
y------------------------------y ----------- y/2 mol
H2SO4 + MgO → MgSO4 + H2O
0,02 -------- 0,02 mol
Ta có hệ phương trình
1 n(khí) = x + y/2 = 0,02
2 n(H2SO4) = y = 0,02
Giải 1 2 có x = 0,01; y = 0,02
→ m(dung dịch giảm) = m(Cu) + m(Cl2) + m(O2) = 2,95 gam

Đáp án B
Khi điện phân trong 9264 giây thì
n
e
=
I
t
/
F
=
0
,
24
m
o
l
, lúc này: 
![]()
Mà m k h í = 71 u + 32 v = 25 , 75 . 2 u + v → u = v = 0 , 04
Khi điện phân t giây:
![]()
![]()
Þ Tổng mol khí = b + c + 0,04 = 0,11.
Bảo toàn electron: 2a + 2b = 0,04.2 + 4c
Và 0,04 + c = 10b
Þ a = 0,15; b = 0,01; c = 0,06
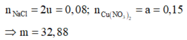

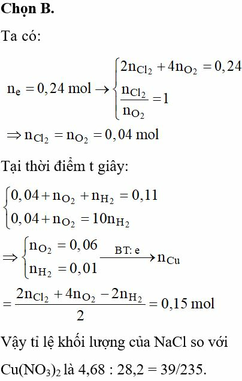
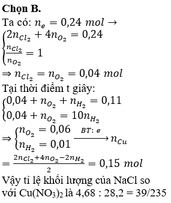
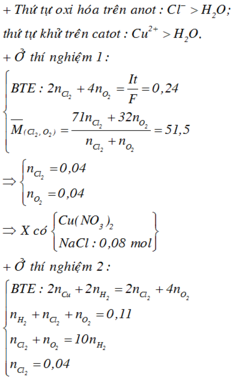
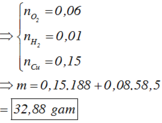
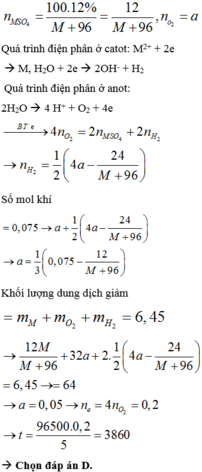
Vì các định luật Fa-ra-đây có thể áp dụng cả đối với các chất được giải phóng ở điện cực nhờ phản ứng phụ nên có thể dùng định luật này đế tìm khôi lượng ôxi bay ra.