Có 2,88g hỗn hợp A gồm Fe, FeO, Fe2O3. Hoà tan hỗn hợp A bằng dung dịch H2SO4 loãng thu được 0,224 lít H2 (đktc).
Mặt khác lấy 5,76g hỗn hợp A khử bằng H2 đến khi hoàn toàn thu được 1,44g H2O. Tính % khối lượng mỗi chất trong hỗn hợp A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: Fe + H2SO4 → FeSO4 + H2 ↑
Số mol của H2 là: 0,224 : 22,4 = 0,01(mol)
Số mol của Fe là: 0,01 mol
Khối lượng của Fe là: 0,01 . 56 = 0,56 gam
Khối lượng FeO và Fe2O3 trong 5,76 gam hỗn hợp X là: 5,76 - 1,12 = 4,64 (gam)
PTHH: FeO + H2 → Fe + H2O
Fe2O3 + 3H2 → 2Fe + 3H2O
Gọi số mol của FeO là a , Số mol của Fe2O3 là b
=> Số mol của H2O ở pt (1) là a, Số mol của H2O ở pt (2) là 3b
Ta có hệ phương trình:
=> a = 0,02 ; b = 0,02
Khối lượng của FeO trong 5,76 gam hỗn hợp X là:
72a = 72 . 0,02 = 1,44 (gam)
Khối lượng của Fe2O3 trong 5,76 gam hỗn hợp X là:
160b = 160 . 0,02 = 3,2 (gam)
% FeO trong hh X là: (1,44 : 5,76).100% = 25%
% Fe2O3 trong hh X là: (3,2:5,76).100% = 55,56%
% Fe trong hh X là: (1,12 : 5,76 ) .100% = 19,44%

\(m_{H_2}=0,01a\left(g\right)\)
=> \(n_{H_2}=\dfrac{0,01a}{2}=0,005a\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,005a<----------------0,005a
=> mFe = 56.0,005a = 0,28a (g)
Gọi số mol FeO, Fe2O3 là x, y (mol)
=> 72x + 160y = a - 0,28a = 0,72a (1)
\(m_{H_2O}=0,2115a\left(g\right)\)
=> \(n_{H_2O}=\dfrac{0,2115a}{18}=0,01175a\left(mol\right)\)
PTHH: FeO + H2 --to--> Fe + H2O
x---------------------->x
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
y----------------------------->3y
=> x + 3y = 0,01175a (2)
(1)(2) => \(\left\{{}\begin{matrix}x=0,005a\left(mol\right)\\y=0,00225a\left(mol\right)\end{matrix}\right.\)
=> \(\%Fe=\dfrac{0,28a}{a}.100\%=28\%\)
\(\%FeO=\dfrac{72.0,005a}{a}.100\%=36\%\)
\(\%Fe_2O_3=\dfrac{160.0,00225a}{a}.100\%=36\%\)
\(m_{H_2}=0,01a\left(g\right)\\ \Rightarrow n_{Fe}=n_{H_2}=0,005a\left(mol\right)\\\Rightarrow m_{FeO,Fe_2O_3}=a-0,005a.56=0,72a\\ Đặt:n_{FeO}=x\left(mol\right);n_{Fe_2O_3}=y\left(mol\right)\left(x,y>0\right)\\ \Rightarrow72x+160y=0,72a\left(1\right)\\ m_{H_2O}=0,2115a\\ \Leftrightarrow18x+54y=0,2115a\left(2\right)\\ \left(1\right),\left(2\right)\Rightarrow\dfrac{504}{47}x=\dfrac{1120}{47}y\\ \Rightarrow\dfrac{x}{y}=\dfrac{\dfrac{1120}{47}}{\dfrac{504}{47}}=\dfrac{20}{9}\\ \Rightarrow\%m_{Fe}=\dfrac{0,28a}{a}.100=28\%\\Ta.có:x.72+0,45x.160=0,72a\\ \Leftrightarrow144x=0,72a\\ \Leftrightarrow\dfrac{x}{a}=\dfrac{0,72}{144}=0,005\\ \Rightarrow\%m_{FeO}=\dfrac{72.0,005a}{a}.100=36\%\)
\(\Rightarrow\%m_{Fe_2O_3}=100\%-\left(28\%+36\%\right)=36\%\)

Đáp án : A
nH2 = 0,25 mol; nSO2 = 0,3 mol
2H+ + 2e → H2 S+6 + 2e → S+4
0,5 <-- 0,25 0,6 <-- 0,3
nFe = 0,6 – 0,5 = 0,1 mol
=> mFe = 5,6g

Đáp án B
Quy đổi hỗn hợp X về hỗn hợp hai chất FeO và Fe2O3 với số mol là x, y
Ta có:
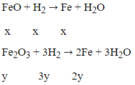
Có: x + 3y = 0,05 và 72x +160y = 3,04
⇒ x = 0,02mol; y = 0,01mol

Vậy VSO2 = 0,01 . 22,4 = 0,224 lít hay 224ml

Đáp án B
- Khi cho hỗn hợp tác dụng với H2SO4 loãng dư chỉ có Mg phản ứng sinh ra khí H2 => nMg=nH2=0,15 mol
- Khi cho hỗn hợp tác dụng với HNO3 dư => Chỉ có Cu và Mg (kim loại thay đổi số oxi hóa)
BT e: nCu=(3nNO-2nMg)/2=0,15 mol
=>mCu=0,15.64=9,6 gam