Nhiệt phân hoàn toàn KClO3 thu đc V lít khí O2 cho toàn bộ lượng O2 tác dụng hết vs than nóng đỏ thì thu đc 8,96 l hh x (đktc) gồm 2 khí d/H2=18. Tính m
mong mọi người giúp e vs ạ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Y gồm CO ( a mol ) và CO2 (b mol )
Có a + b = nY = 0,04 (1)
MY = 16.2 = 32 ⇒ 32(a + b) = 28a + 44b (2)
Từ (1) và (2) ⇒ a = 0,03 ; b= 0,01
Bảo toàn nguyên tố O⇒ nO2 = ( a + 2b )/2 = 0,025
2KClO3 → 2KCl + 3O2
x 3x/2
2KMnO4 → K2MnO4 + MnO2 + O2
y y/2
Có hệ :
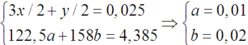
⇒ %mKMnO4 = 158×0,02 : 4,385 = 72,06%
Đáp án B

Đáp án C
C nóng đỏ phản ứng với O2 thu được hỗn hợp khí có M=32
Þ 2 khí là CO và CO2 với tổng số mol bằng 0,04. Dùng quy tắc đường chéo được
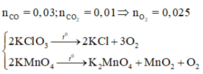
Gọi
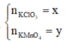
Có
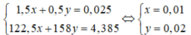
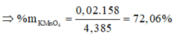

Đáp án C
C nóng đỏ phản ứng với O2 thu được hỗn hợp khí có M ¯ = 32
Þ 2 khí là CO và CO2 với tổng số mol bằng 0,04. Dùng quy tắc đường chéo được


a)nO2=\(\dfrac{3.36}{22.4}\)=0,15(mol)
2KMnO4(to)→K2MnO4+MnO2+O2
Theo PT: nKMnO4=2nO2=0,3(mol)
→m=mKMnO4=0,3.158=47,4(g)
b)nH2=\(\dfrac{8.96}{22.4}\)=0,4(mol)
2H2+O2(to)→2H2O
Vì \(\dfrac{nH_2}{2}\)<nO2→O2nH2 dư
Theo PT: nH2O=nH2=0,4(mol)
→mH2O=0,4.18=7,2(g)
Ta có: \(\overline{M}=18\cdot2=36\)
PTHH: \(2KClO_3\xrightarrow[]{t^o}2KCl+3O_2\)
+) Trường hợp 1: Hỗn hợp khí gồm CO2 và Oxi dư
PTHH: \(C+O_2\xrightarrow[]{t^o}CO_2\)
Theo sơ đồ đường chéo: \(\dfrac{n_{CO_2}}{n_{O_2\left(dư\right)}}=\dfrac{36-32}{44-36}=\dfrac{1}{2}\)
Mà \(n_{O_2\left(dư\right)}+n_{CO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{CO_2}=\dfrac{2}{15}\left(mol\right)\\n_{O_2\left(dư\right)}=\dfrac{4}{15}\left(mol\right)\end{matrix}\right.\) \(\Rightarrow n_{O_2\left(ban.đầu\right)}=\dfrac{2}{15}+\dfrac{4}{15}=0,4\left(mol\right)\)
\(\Rightarrow n_{KClO_3}=\dfrac{4}{15}\left(mol\right)\) \(\Rightarrow m_{KClO_3}=\dfrac{4}{15}\cdot122,5\approx32,7\left(g\right)\)
+) Trường hợp 2: Hỗn hợp khí gồm CO và CO2
PTHH: \(C+O_2\xrightarrow[]{t^o}CO_2\)
\(2C+O_2\xrightarrow[]{t^o}2CO\)
Theo sơ đồ đường chéo: \(\dfrac{n_{CO_2}}{n_{CO}}=1\) \(\Rightarrow n_{CO_2}=n_{CO}=0,2\left(mol\right)\)
\(\Rightarrow n_{O_2}=0,2+0,1=0,3\left(mol\right)\)
\(\Rightarrow n_{KClO_3}=0,2\left(mol\right)\) \(\Rightarrow m_{KClO_3}=0,2\cdot122,5=24,5\left(g\right)\)