Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(\left\{{}\begin{matrix}n_{MgO}=\dfrac{6}{40}=0,15\left(mol\right)\\n_{HCl}=0,05\cdot0,4=0,02\left(mol\right)\end{matrix}\right.\)
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{Mg\left(OH\right)_2}=n_{MgO}=0,15\left(mol\right)\\n_{NaOH}=n_{NaCl}=n_{HCl}=0,02\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow a=m_{NaOH}+m_{Mg\left(OH\right)_2}=0,02\cdot40+0,15\cdot58=9,5\left(g\right)\)

Trong dd ban đầu:
K+_____a mol
Mg2+___b mol
Na+____c mol
Cl-_____a + 2b + c mol
mhhbđ = 74.5a + 95b + 58.5c = 24.625 g______(1)
nAgNO3 = 0.3*1.5 = 0.45 mol
Cho Mg vào A có phản ứng (theo gt) nên Ag(+) còn dư, Cl(-) hết. Rắn C gồm Ag và có thể cả Mg còn dư nữa. Thật vậy, khi cho rắn C vào HCl loãng thì khối lượng rắn bị giảm đi, chính do Mg pư, Ag thì không. Vậy mrắn C giảm = mMg chưa pư với A = 1.92 g.
=> nMg dư = 1.92/24 = 0.08 mol
=> nMg pư với A = 2.4/24 - 0.08 = 0.02 mol________(*)
Khi cho Mg vào A có pư:
Mg + 2Ag(+) ---> 2Ag(r) + Mg(2+)
0.02__0.04
=> nAg(+) pư với dd ban đầu = 0.45 - 0.04 = 0.41 mol
Ag(+) + Cl(-) ---> AgCl(r)
0.41___0.41
Có: nCl(-) = a + 2b + c = 0.41_____________(2)
Trong các cation trên, Mg(2+) và Ag(+) có pư với OH(-), tuy nhiên trong D chỉ có Mg(2+) nên kết tủa là Mg(OH)2:
Mg(2+) + 2OH(-) ---> Mg(OH)2
Khi nung:
Mg(OH)2 ---> MgO + H2O
Ta có: nMg(2+)trongD = nMgO = 4/40 = 0.1 mol
Trong đó 0.02 mol Mg(2+) được thêm vào bằng cách cho kim loại Mg vào (theo (*)), vậy còn lại 0.08 mol Mg(2+) là thêm từ đầu, ta có:
b = 0.08 mol_________________________(3)
(1), (2), (3) => a = 0.15, b = 0.08, c = 0.1
mKCl = 74.5*0.15 = 11.175 g
mMgCl2 = 95*0.08 = 7.6 g
mNaCl = 58.5*0.1 = 5.85 g

Ba(OH)2 dư => Zn(OH)2 tan hết , kết tủa chỉ là Mg(OH)2.
\(n_{Mg}=n_{MgO}=\dfrac{52.6}{40}=1.315\left(g\right)\)
\(m_{Mg}=1.315\cdot24=31.56\left(g\right)>m_{hh}\)
Đề sai !

Đáp án C
nMg = 0,04. Thứ tự các phản ứng xảy ra:
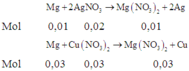
Do đó dung dịch B có chứa 0,04 mol Mg(NO3)2 và Cu(NO3)2 dư.
Khi cho NH3 dư vào B thu được kết tủa duy nhất là Mg(OH)2 (Cu(OH)2 tạo phức tan được NH3)
Đem nung kết tủa thì được chất rắn là MgO. Có nMgO = n M g ( N O 3 ) 2 = 0,04
Vậy mMgO = 1,6 (gam)

\(B:ddNaOH\)
\(C:Mg\left(OH\right)_2\)
\(Mg\left(OH\right)_2\rightarrow^{t^o}MgO+H_2O\)
\(NaOH+HCl\rightarrow NaCl+H_2O\)
\(n_{Mg\left(OH\right)_2}=n_{Mg}=\frac{6}{40}=0,15mol\)
\(n_{HCl}=\frac{50}{1000}.0,4=0,02mol\)
\(n_{NaOH}=n_{HCl}=0,02mol\)
\(a=0,02.40+0,15.58=9,5g\)