Hỗn hợp M gồm một hidrocacbon mạch hở A và một hidrocacbon X có công thức CxH2x-2 (x \(\ge\) 2)., có tỉ lệ số mol là 2:1. Tỉ khối của hỗn hợp so với hidro bằng 25,33. Đốt cháy hoàn toàn 3,36 lít (đktc) hỗn hợp M, sau đó dẫn toàn bộ sản phẩm đi vào 1000 gam dung dịch Ca(OH)2 7,4% thấy có 55 gam kết tủa. Lọc kết tủa, sau đó nếu đun sôi dung dịch thì không thấy có thêm kết tủa xuất hiện.
1) Tìm CTPT của A và X biết chngs hơn kém nhau 1 nguyên tử cacbon
2) Tính nồng độ phần trăm của dung dịch sau khi lọc bở kết tủa.

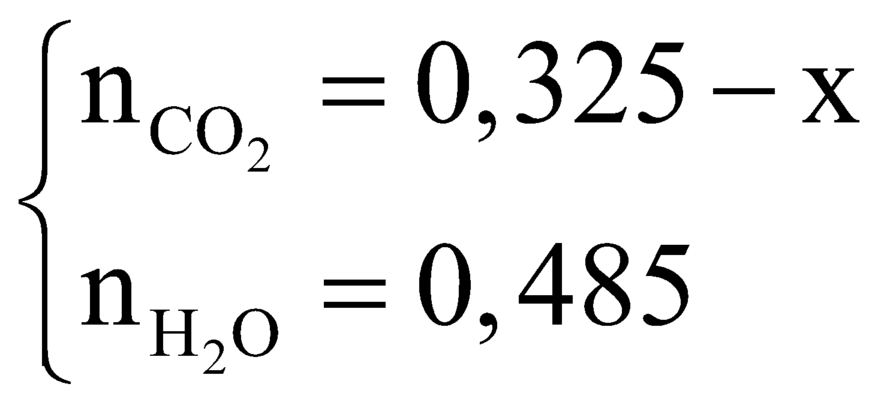
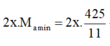
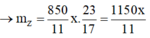
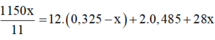



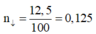
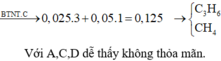
Đặt công thức A là CaHb
M tb của hỗn hợp:25,33.2=50,66
Số mol của hỗn hợp M là 3,36:22,4=0,15
-->Số mol của CaHb là 0,1; của CxH2x –2 là 0,05
Khối lượng của hỗn hợp là 50,66.0,15=7,6(g)
Đun sôi dung dịch không thấy có thêm kết tủa --> Vậy chỉ có phản ứng
Ca(OH)2+CO2-->CaCO3+H2O(1)
nCaCO3= số mol CO2=0,55-->mCO2=24,2 (g)
nC=0,55-->mC=12.0,55=6,6
-->mH=7,6-6,6=1
-->nH=1-->số mol H2O=0,5
PTTH CaHb + (a+b/4)O2 --> aCO2 + b/2H2O (2)
CxH2x–2+(3x -1)/2O2->xCO2 + (x-1)H2O (3)
Từ (2) và (3)
--> 0,1a + 0,05x = 0,55 (I)
--> 0,05b + 0,05 (x-1) = 0,5 (II)
Giải (I) và (II) 2a = b
Công thức HĐCB A có thể viết là CaH2a
Có 2 trường hợp xảy ra, khi 2 HĐCB khác nhau 1 nguyên tử C
+ TH1: CaH2a và C(a + 1)H 2(a+1) – 2
-->0,1a+0,05(a+1)=0,55
Giải ra a~3,33 Loại
+ TH2: CaH2a và C (a-1)H2(a-1) -2
-->0,1a + 0,05 (a-1) = 0,55
Giải ra a = 4 --> CTPT hai HĐCB là C4H8 và C3H4
thưa cô Cẩm Vân Nguyễn Thị e lm đúng chưa ạ