Cho 200 ml dung dịch axit sunfuric 2 M tác dụng với 300 ml dung dịch Natri hidroxit 3 M. Tính CM các chất sau phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Fe có số mol là \(n_{Fe}=\frac{m}{M}=\frac{11,2}{56}=0,2mol\)
\(H_2SO_4\) có số mol là \(n_{H_2SO_4}=\frac{0,2.1}{1}=0,2mol\)
Có \(V=200ml=0,2l\)
\(\rightarrow C_M=\frac{n_{H_2SO_4}}{V_{H_2SO_4}}=\frac{0,2}{0,2}=1M\)
FeSO\(_4\) có số mol là \(n_{FeSO_4}=\frac{0,2.1}{1}=0,2mol\)
Thể tích của \(FeSO_4\) là \(V_{FeSO_4}=V_{H_2SO_4}\rightarrow C_M=\frac{n}{V}=\frac{0,2}{0,2}=1M\)

Fe+H2SO4->feSO4+H2
0,2--0,2---------0,2------0,2
n H2SO2=0,2 mol
=>m Fe=0,2.56=11,2g
=>Cm FeSO4=0,2\0,2=1M
\(n_{H_2SO_4}=0,2.1=0,2\left(mol\right)\\ a.Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ 0,2........0,2.........0,2...........0,2\left(mol\right)\\ b.V_{dd.muối}=V_{ddH_2SO_4}=200\left(ml\right)=0,2\left(l\right)\\ C_{MddFeSO_4}=\dfrac{0,2}{0,2}=1\left(M\right)\)

\(a,\) Đặt hóa trị của M là \(x(x>0)\)
\(n_{H_2}=\dfrac{0,672}{22,4}=0,03(mol)\\ PTHH:2M+2xHCl\to 2MCl_x+xH_2\\ \Rightarrow n_{M}=\dfrac{0,03}{x}.2=\dfrac{0,06}{x}(mol)\\ \Rightarrow M_M=\dfrac{0,72}{\dfrac{0,06}{x}}=12x\)
Thay \(x=2\Rightarrow M_M=24(g/mol)\)
Vậy M là magie (Mg)
\(b,n_{HCl}=0,5.0,2=0,1(mol)\)
Vì \(\dfrac{n_{HCl}}{2}>\dfrac{n_{H_2}}{1}\) nên \(HCl\) dư
\(\Rightarrow n_{MgCl_2}=n_{H_2}=0,03(mol)\\ \Rightarrow C_{M_{MgCl_2}}=\dfrac{0,03}{0,2}=0,15M\)

a,\(n_{H_2SO_4}=0,5.0,2=0,1\left(mol\right)\)
PTHH: H2SO4 + 2KOH → K2SO4 + H2O
Mol: 0,1 0,2 0,2
b,\(C_{M_{ddKOH}}=\dfrac{0,2}{0,05}=4M\)
c, Vdd sau pứ = 0,2+0,05 = 0,25 (l)
\(C_{M_{ddK_2SO_4}}=\dfrac{0,1}{0,25}=0,4M\)

a,\(n_{H_2SO_4}=0,5.0,2=0,1\left(mol\right)\)
PTHH: H2SO4 + 2KOH → K2SO4 + 2H2O
Mol: 0,1 0,2 0,1
b,\(C_{M_{ddKOH}}=\dfrac{0,2}{0,05}=4M\)
c,Vdd sau pứ = 0,2+0,05 = 0,25 (l)
\(C_{M_{ddK_2SO_4}}=\dfrac{0,1}{0,25}=0,4M\)

Đáp án B
Nhận thấy từ đáp án X đều chwuas 1 nhóm NH2 và 1 nhóm COOH → Công thức của X là (NH2)R COOH
Coi bài toán tương đương cho 0,2 mol HCl tác dụng với NaOH trước, sau đó X mới tác dụng với NaOH → nX = nNaOH - nHCl = 0,1 mol
Luôn có nH2O= nNaOH = 0,3 mol
Bảo toàn khối lượng → mX = 22,8 + 0,3. 18 - 0,2. 36,5 - 0,3. 40 = 8,9 gam → M = 89 ( CH3-CH(NH2)-COOH)
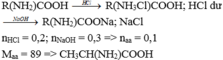
200ml = 0,2l
300ml = 0,3l
\(n_{H2SO4}=2.0,2=0,4\left(mol\right)\)
\(n_{NaOH}=3.0,3=0,9\left(mol\right)\)
Pt : \(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O|\)
1 2 1 2
0,4 0,9 0,4
Lập tỉ số so sánh: \(\dfrac{0,4}{1}< \dfrac{0,9}{2}\)
⇒ H2SO4 phản ứng hết , NaOH dư
⇒ Tính toán dựa vào số mol của H2SO4
\(n_{Na2SO4}=\dfrac{0,4.1}{1}=0,4\left(mol\right)\)
\(n_{NaOH\left(dư\right)}=0,9-\left(0,4.2\right)=0,1\left(mol\right)\)
\(V_{ddspu}=0,2+0,3=0,5\left(l\right)\)
\(C_{M_{Na2SO4}}=\dfrac{0,4}{0,5}=0,8\left(M\right)\)
\(C_{M_{NaOH\left(dư\right)}}=\dfrac{0,1}{0,5}=0,2\left(M\right)\)
Chúc bạn học tốt
Na2SO4
Ta có 200ml=0,2 l , 300ml =0,3l
Số mol H2So4 là : Cm. V = 0,2.2=0,4
Số mol Naoh là : Cm.v =0,3.3 =0,9
=>NaOh dư . Bài toán tính theo H2So4
Từ đó tính ra đc số mol của H2o và Na2so4 =>Cm