Ðộ điện li của axit HF nồng độ không quá nhỏ trong dung dịch nước có giá trị A.α = 1 B. α = 0 C. 0 < α < 1 D. 0 < α≤ 1
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


ta có : 0,01>4,47.10-7=>[H+]=0,01=> pH = -log(H+)
=> pH = -log(0,01) = 2
:)

Gọi khối lượng axit trong dung dịch A là x; khối lượng nước trong dung dịch A là y (kg; x, y > 0)
Người ta cho thêm 1kg nước vào dung dịch A thì được dung dịch B có nồng độ axit là 20% nên ta có:
x x + y + 1 = 20% ↔ 0,8x – 0,2y = 0,2 (1)
Lại cho thêm 1kg axit vào dung dịch B thì được dung dịch C có nồng độ axit là 100/3 % nên ta có:

Đáp án: C

- Đáp án D
- Do CH3COOH là chất điện li yếu nên trong nước chỉ phân li một phần
CH3COOH ⇌ H+ + CH3COO-
Vì vậy [H+] < [CH3COO-]= 0,1M

- Đáp án A
- Do HNO3 là chất điện li mạnh nên nó phân li hoàn toàn trong dung dịch
HNO3 → H+ + NO3-
0,1 0,1 0,1 (M)
⇒ [H+ ] = [NO3- ] = 0,1M

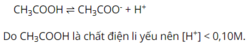
Ðộ điện li của axit HF nồng độ không quá nhỏ trong dung dịch nước có giá trị A.α = 1 B. α = 0 C. 0 < α < 1 D. 0 < α≤ 1