giúp mình 2 câu này với 
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



7:
a: \(P=\left(1:\dfrac{x-x+1}{\sqrt{x}+\sqrt{x-1}}-\dfrac{x-1-2}{\sqrt{x-1}-\sqrt{2}}\right)\cdot\left(\dfrac{2\sqrt{x}-\sqrt{x}-\sqrt{2}}{\sqrt{x}\left(\sqrt{2}-\sqrt{x}\right)}\right)\)\(=\left(\sqrt{x}+\sqrt{x-1}-\sqrt{x-1}-\sqrt{2}\right)\cdot\dfrac{\sqrt{x}-\sqrt{2}}{\sqrt{x}\left(\sqrt{2}-\sqrt{x}\right)}\)
\(=-\dfrac{\left(\sqrt{x}-\sqrt{2}\right)}{\sqrt{x}}\)
b: Khi x=3-2căn 2 thì \(P=-\dfrac{\sqrt{2}-1-\sqrt{2}}{\sqrt{2}-1}=\dfrac{1}{\sqrt{2}-1}=\sqrt{2}+1\)

a) \(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
b) \(n_{H_2}=n_{Ba}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
=> \(m_{Ba}=0,3.137=41,1\left(g\right)\)
=> \(m_{CaO}=52,3-41,1=11,2\left(g\right)\)
c) \(n_{CaO}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Dung dịch Y gồm Ba(OH)2 và Ca(OH)2
\(m_{ddsaupu}=52,3+500-0,3.2=551,7\left(g\right)\)
=> \(C\%_{Ba\left(OH\right)_2}=\dfrac{0,3.171}{551,7}.100=9,3\%\)
\(C\%_{Ca\left(OH\right)_2}=\dfrac{0,2.74}{551,7}.100=2,68\%\)
Câu 2: \(K+H_2O\rightarrow KOH+\dfrac{1}{2}H_2\)
\(2K+H_2SO_4\rightarrow K_2SO_4+H_2\)
\(BaO+CO_2\rightarrow BaCO_3\)
\(BaO+SO_2\rightarrow BaSO_3\)
\(BaO+H_2O\rightarrow Ba\left(OH\right)_2\)
\(BaO+H_2SO_4\rightarrow BaSO_4+H_2O\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(CO_2+H_2O⇌H_2CO_3\)
\(SO_2+H_2O⇌H_2SO_3\)


Câu 1 :
Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a) Fe + H2SO4 → FeSO4 + H2\(|\)
1 1 1 1
0,15 0,15
b) Số mol của sắt
nFe = \(\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,15 .56
= 8,4 (g)
Số mol của dung dịch axit sunfuric
nH2SO4 = \(\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
50ml = 0,05l
Nồng độ mol của dung dịch axit sunfuric
CMH2SO4 = \(\dfrac{n}{V}=\dfrac{0,15}{0,05}=3\left(M\right)\)
Chúc bạn học tốt
Câu 2 :
20ml = 0,02l
Số mol của dung dịch axit sunfuric
CMH2SO4 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1.0,02=0,02\left(mol\right)\)
a) Pt : 2NaOH + H2SO4 → Na2SO4 + 2H2O\(|\)
2 1 1 2
0,04 0,02
b) Số mol của natri hidroxit
nNaOH = \(\dfrac{0,02.2}{1}=0,04\left(mol\right)\)
Khối lượng của natri hidroxit
mNaOH = nNaOH . MNaOH
= 0,02 . 40
= 0,8 (g)
Khối lượng của dung dịch natri hidroxit đã dùng
C0/0NaOH = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{0,8.100}{20}=4\left(g\right)\)
c) Pt : 2KOH + H2SO4 → K2SO4 + 2H2O\(|\)
2 1 1 1
0,04 0,02
Số mol của kali hidroxit
nKOH = \(\dfrac{0,02.2}{1}=0,04\left(mol\right)\)
Khối lượng của kali hidroxit
mKOH = nKOH . MKOH
= 0,04 . 56
= 2,24 (g)
Khối lượng của dung dịch kali hidroxit
C0/0KOH = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{2,24.100}{5,6}=40\left(g\right)\)
Thể tích của dung dịch kali hidroxit
D = \(\dfrac{m}{V}\Rightarrow V=\dfrac{m}{D}=\dfrac{40}{1,045}=38,28\left(ml\right)\)
Chúc bạn học tốt

Câu 3 :
Trích mẫu thử :
Cho quỳ tím vào từng mẫu thử :
+ Hóa đỏ : H2SO4 , HCl
+ Hóa xanh : NaOH
+ Không đổi màu : NaCl
Cho dung dịch BaCl2 vào 2 mẫu thử làm quỳ tím hóa đỏ :
+ Chất nào xuất hiện kết tủa trắng không tan trong axit là : H2SO4
Pt : BaCl2 + H2SO4 → BaSO4 + 2HCl
Không hiện tượng : HCl
Chúc bạn học tốt
Bài 4 :
Số mol của khí cacbonic ở dktc
nCO2 = \(\dfrac{V_{CO2}}{22,4}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
a) Pt : CaCO3 + 2HCl → CaCl2 + CO2 + H2O\(|\)
1 2 1 1 1
0,4 0,8 0,4
b) Số mol của canxi cacbonat
nCaCO3 = \(\dfrac{0,4.1}{1}=0,4\left(mol\right)\)
Khối lượng của canxi cacbonat
mCaCO3 = nCaCO3 . MCaCO3
= 0,4 . 100
= 40 (g)
Số mol của dung dịch axit clohidric
nHCl = \(\dfrac{0,4.2}{1}=0,8\left(mol\right)\)
Thể tích của dung dịch axit clohidric
CMHCl = \(\dfrac{n}{V}\Rightarrow V=\dfrac{n}{C_M}=\dfrac{0,8}{0,5}=1,6\left(l\right)\)
Chúc bạn học tốt

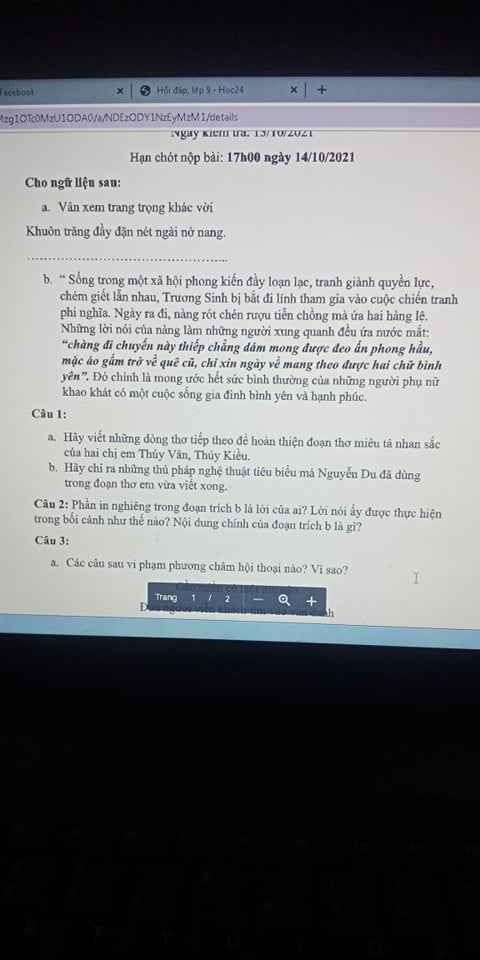 mọi người giúp mình bài này với câu 1 với câu 2 thôi
mọi người giúp mình bài này với câu 1 với câu 2 thôi Giúp mình giải 2 câu này với. Mình cảm ơn
Giúp mình giải 2 câu này với. Mình cảm ơn




