Trộn 240 ml dd có chứa 80g CuSO4 với 260ml dd có chứa 74g Ca(OH)2 a) Tính khối lượng chất rắn thu được sau phản ứng. b) Tính nồng độ mol các chất tan có trong dd sau phản ứng. Biết thể tích dd thay đổi không đáng kể.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1. \(n_{NaOH}=\dfrac{32}{40}=0,8\left(mol\right);n_{H_2SO_4}=\dfrac{245.20\%}{98}=0,5\left(mol\right)\)
\(H_2SO_4+2NaOH\rightarrow Na_2SO_4+H_2O\)
Đề: 0,5.......0,8
Lập tỉ lệ : \(\dfrac{0,5}{1}>\dfrac{0,8}{2}\)=> H2SO4 dư, NaOH hết
\(m_{Na_2SO_4}=\dfrac{0,8}{2}.142=56,8\left(g\right)\)
\(C\%_{Na_2SO_4}=\dfrac{56,8}{32+245}.100=20,51\%\)
\(C\%_{H_2SO_4}=\dfrac{\left(0,5-0,4\right).98}{32+245}.100=3,54\%\)

nMg = 0,252, nHNO3 = 1,2 & nKOH = 1,4
Vậy KOH dư, Mg2+ đã kết tủa hết, phần dung dịch chứa KNO3 & KOH dư, phần kết tủa chứa Mg(OH)2, cô cạn và nung thu được KNO2 & KOH dư & MgO
nKOH ban đầu = nKNO2 + nKOH dư = 1,4
m rắn = 85nKNO2 + 56nKOH dư + 40.0,252 = 118,06
—> nKNO2 = 1,02 & nKOH dư = 0,38
Bảo toàn N —> nN trong khí = nHNO3 – nKNO3 = 0,18
Vậy mỗi N+5 đã nhận 0,252.2/0,18 = 2,8 mol electron
—> Số oxi hóa trung bình của N = 5 – 2,8 = +2,2
—> Oxit trung bình NO1,1 (0,18 mol)
nHNO3 pư = 0,252.2 + 0,18 = 0,684
—> nHNO3 dư = 0,516
mdd = mMg + mddHNO3 – mNO1,1 = 189,36
—> C% HNO3 dư & C% Mg(NO3)2

Đáp án B
Ta có:
![]()
mCu = 0,7m (g)
Vì Fe phản ứng trước Cu và sau khi phản ứng còn 0,75m (g) chất rắn → Cu chưa phản ứng 0,7m
Fe dư 0,75m - 0,7m = 0,05m → mFe pư = 0,2m - 0,05m = 0,25m (g)
Fe dư → Chỉ tạo muối Fe(NO3)2
HNO3 hết (Lưu ý chỉ H+ hết, NO3- còn trong muối).
Quá trình nhường electron:

Quá trình nhận electron:
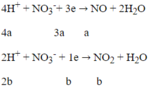
Áp dụng định luật bảo toàn electron:
![]()
→ m = 50,4

PTHH: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{NaOH}=0,2\cdot1=0,2\left(mol\right)\\n_{HCl}=0,1\cdot1=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) NaOH còn dư
\(\Rightarrow\) Dung dịch sau p/ứ có môi trường bazơ
\(\Rightarrow n_{NaCl}=0,1\left(mol\right)=n_{NaOH\left(dư\right)}\) \(\Rightarrow C_{M_{NaCl}}=\dfrac{0,1}{0,2+0,1}\approx0,33\left(M\right)=C_{M_{NaOH\left(dư\right)}}\)

Gọi a, b, c lần lượt là số mol của Fe, Al, Cu trong mỗi phần
+Phần 1:
PƯ: Fe + 2HCl FeCl2 + H2↑
(mol) a a
2Al + 6HCl 2AlCl3 + 3H2↑
(mol) b 3b/2
Ta có: nH2=0.448/22.4=0.02 mol
Sau phản ứng thu được 0.2 gam chất rắn, đây chính là khối lượng của đồng
=>mCu=0.2mol
Theo đề ta có hệ phương trình:
56a + 27b + 0,2 = 1.5/2 <=> 56a + 27b = 0,55
a + 3b/2 = 0,02 <=> 2a + 3b = 0,04
=> Giải hệ phương trình ta được a = 0,005
b = 0,01
Vậy khối lượng kim loại trong hỗn hợp đầu:
mCu = 0,2 x 2 = 0,4 (gam)
mFe = 0,005 x 2 x 56 = 0,56 (gam)
mAl = 0,01 x 2 x 27 = 0,54 (gam)
+Phần 2:
PƯ: Al + 3AgNO3 Al(NO3)3 + 3Ag (1)
(mol) 0,01 0,03 0,01 0,03
2Al + 3Cu(NO3)2 2Al(NO3)3 + 3Cu (2)
Fe + 2AgNO3 Fe(NO3)2 + 2Ag (3)
(mol) 0,001 0,002 0,001 0,002
Fe + Cu(NO3)2 Fe(NO3)2 + Cu (4)
(mol) 0,004 0,004 0,004 0,004
Cu + 2AgNO3 2Ag + Cu(NO3)2 (5)
a) Xác định thành phần định tính và định lượng của chất rắn A.
Từ PƯ (1)--> (5); Hỗn hợp A gồm: Ag, Cu.
Ta có: nAgNo3 = CM.V=0.08x.0.4=0.032 mol
Và nCu(No3)2 = CM.V=0.5x.0.4=0.2 mol
Từ (1) => số mol của AgNO3 dư: 0,032 - 0,03 = 0,002 (mol)
Từ (4) => số mol của Cu(NO3)2 phản ứng: 0,004 mol
=> số mol Cu(NO3)2 còn dư: 0,2 - 0,004 = 1,196 (mol)
Vậy từ PƯ (1), (3), (4) ta có:
Số mol của Cu sinh ra: 0,004 (mol)
=> mCu thu được = 0,004 x 64 + 0,2 = 0,456 (gam)
Số mol của Ag sinh ra: 0,03 + 0,002 = 0,032 (gam)
=> mAg = 0,032 x 108 = 3,456 (gam)
b) Tính nồng độ mol/ lít các chất trong dung dịch (B):
Từ (1) => nAl(No3)2 = 0.01 mol
=>CmAl(No3)3= 0.01/0.4=0.025 M
Từ (3) và (4) =>nFe(NO3)2= 0.001+0.004 = 0.005 mol
=> CmFe(NO3)2=0.005/0.4=0.012 M
Số mol của Cu(NO3)2 dư: 0.196 (mol)
CmCu(NO3)2dư=0.196/0.4=0.49M
CuSO4+Ca(OH)2--> Cu(OH)2+ CaSO4 (1)
a) nCuSO4=0,5(mol)
nCa(OH)2=0,1(mol)
lập tỉ lệ :
\(\dfrac{0,5}{1}>\dfrac{0,1}{1}\)
=>CuSO4 dư , Ca(OH)2 hết => bài toán tính theo Ca(OH)2
theo (1) : nCuSO4(pư)=nCu(OH)2=nCaSO4=nCa(OH)2=0,1(mol)
=>mCu(OH)2=9,8(g)
mCaSO4=13,6(g)
b)Vdd=500ml=0,5l
nCuSO4(dư)=0,4(mol)
=> CM dd CuSO4 dư=\(\dfrac{0,4}{0,5}=0,8\left(M\right)\)