b. Cho axit sunfuric (H2SO4) phản ứng vừa hết với 20,4 gam nhôm oxit (Al2O3); tạo ra Al2(SO4)3 và nước. Tính khối lượng H2SO4 đã phản ứng và khối lượng muối (Al2(SO4)3) thu được
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Pt : Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
1 3 1 3
0,03 0,1 0,03
b) Số mol của axit sunfuric
nH2SO4 = \(\dfrac{m_{H2SO4}}{M_{H2SO4}}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
Số mol của nhôm sunfat
nAl2(SO4)3 = \(\dfrac{0,1.1}{3}=0,03\left(mol\right)\)
Khối lượng của nhôm sunfat
mAl2(SO4)3 = nAl2(SO4)3 . MAl2(SO4)3
= 0,03 . 342
= 10,26 (g)
c) Số mol của nhôm oxit
nAl2O3 = \(\dfrac{0,1.1}{3}=0,03\left(mol\right)\)
Khối lượng của nhôm oxit
mAl2O3 = nAl2O3 . MAl2O3
= 0,03 . 102
= 3,06 (g)
Chúc bạn học tốt

`a)PTHH:`
`2Al + 3H_2 SO_4 -> Al_2(SO_4)_3 + 3H_2 \uparrow`
`2` `3` `1` `3` `(mol)`
`b)n_[H_2 SO_4]=[300.98]/[100.98]=3(mol)`
`m_[Al]=2.27=54(g)`
`m_[Al_2(SO_4)_3=1.342=342(g)`
`V_[H_2]=3.22,4=67,2(l)`

a) Al2O3 + 3H2SO4 --> Al2(SO4)3 + 3H2O
b) \(n_{Al_2O_3}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
PTHH: Al2O3 + 3H2SO4 --> Al2(SO4)3 + 3H2O
0,1---->0,3------->0,1
=> m = 0,1.342 = 34,2 (g)
c) \(C\%_{dd.H_2SO_4}=\dfrac{0,3.98}{120}.100\%=24,5\%\)

PTHH: \(4Al+3O_2\xrightarrow[]{t^0}2Al_2O_3\)
Theo ĐLBTKL: \(m_{Al}+m_{O_2}=m_{Al_2O_3}\)
\(\Rightarrow m_{Al}=m_{Al_2O_3}-m_{O_2}=20,4-9,6=10,8\left(g\right)\Rightarrow A\)

Phương trình hóa học của phản ứng:
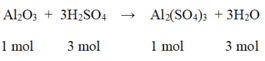
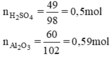
So sánh tỉ lệ 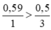 → Vậy Al2O3 dư
→ Vậy Al2O3 dư
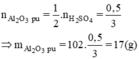
mAl2O3 (dư) = 60 - 17 = 43(g)
\(n_{Al2O3}=\dfrac{20,4}{102}=0,2\left(mol\right)\)
Pt : \(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O|\)
1 3 1 3
0,2 0,6 0,2
\(n_{H2SO4}=\dfrac{0,2.3}{1}=0,6\left(mol\right)\)
⇒ \(m_{H2SO4}=0,6.98=58,8\left(g\right)\)
\(n_{Al2\left(SO4\right)3}=\dfrac{0,6.1}{3}=0,2\left(mol\right)\)
⇒ \(m_{Al2\left(SO4\right)3}=0,2.342=68,4\left(g\right)\)
Chúc bạn học tốt