Cho các kl sau: Ba,Fe, Mg,Al,Ag,chỉ dùng H2SO4 loãng có thể nhận bt đc kl nào
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
Hướng dẫn
Trích mẩu thử cho mỗi lần thí nghiệm. Cho dung dịch H2SO4 loãng lần lượt vào các mẩu thử.
- Kim loại không tan là Ag, các kim loại còn lại tan và tạo khí H2 và các dung dịch muối.
- Trường hợp tạo kết tủa là Ba. Lọc bỏ kết tủa rồi lấy dung dịch nước lọc có chứa Ba(OH)2 cho tác dụng với các dung dịch muối ở trên.
+ Dung dịch tạo kết tủa trắng xanh rồi hóa nâu là FeSO4.
=> kim loại ban đầu là Fe.
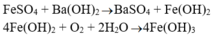
+ Dung dịch tạo kết tủa keo trắng rồi tan dần là Al2(SO4)3 => kim loại
ban đầu là Al.
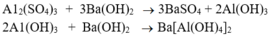
+ Dung dịch tạo kết tủa trắng là MgSO4 => kim loại ban đầu là Mg.
![]()

Trích mẩu thử cho mỗi lần thí nghiệm. Cho dung dịch H2SO4 loãng lần lượt vào các mẩu thử.
- Kim loại không tan là Ag, các kim loại còn lại tan và tạo khí H2 và các dung dịch muối.
- Trường hợp tạo kết tủa là Ba. Lọc bỏ kết tủa rồi lấy dung dịch nước lọc có chứa Ba(OH)2 cho tác dụng với các dung dịch muối ở trên.
+ Dung dịch tạo kết tủa trắng xanh rồi hóa nâu là FeSO4.
=> kim loại ban đầu là Fe.
+ Dung dịch tạo kết tủa keo trắng rồi tan dần là Al2(SO4)3 => kim loại
ban đầu là Al.
+ Dung dịch tạo kết tủa trắng là MgSO4 => kim loại ban đầu là Mg.

Chọn đáp án D.
Chia các kim loại cần nhận biết thành nhiều phần, mỗi thí nghiệm thực hiện với 1 phần:
- Cho H2SO4 loãng vào từng lọ chứa kim loại.
+ Nhận ra: Ag (không hiện tượng) và Ba (vừa có khí không màu thoát ra, vừa xuất hiện kết tủa trắng).
+ 3 kim loại Al, Mg, Fe (đều có khí không màu thoát ra).
- Cho tiếp Ba vào dung dịch H2SO4 loãng, lọc bỏ kết tủa, tiếp tục cho Ba vào và lọc bỏ kết tủa, lặp lại nhiều lần đến khi không còn xuất hiện kết tủa, thu lấy dung dịch nước lọc (chứa Ba(OH)2 được tạo thành sau khi H2SO4 hết. Ba tiếp tục tác dụng với H2O) cho vào dung dịch muối thu được ở trên từ 3 kim loại Al, Mg, Fe.
+ Xuất hiện kết tủa keo trắng sau đó kết tủa tan. Mẫu thử là Al.
+ Xuất hiện kết tủa trắng, không tan. Mẫu thử là Mg.
+ Xuất hiện kết tủa trắng xanh, để trong không khí chuyển thành kết tủa nâu đỏ. Mẫu thử là Fe

Câu 1 : Đáp án B
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
$Zn + 2HCl \to ZnCl_2 + H_2$
$Mg + 2HCl \to MgCl_2 + H_2$
$2Na +2 HCl \to 2NaCl + H_2$
Câu 2 : Đáp án A
$2Al +3 H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$FeO + H_2SO_4 \to FeSO_4 + H_2O$
$Mg + H_2SO_4 \to MgSO_4 + H_2$
$2Al(OH)_3 + 3H_2SO_4 \to Al_2(SO_4)_3 + 6H_2O$
$2NaOH + H_2SO_4\to Na_2SO_4 + 2H_2O$
$BaCl_2 + H_2SO_4 \to BaSO_4 + 2HCl$
$MgCO_3 + H_2SO_4 \to MgSO_4 + CO_2 + H_2O$
Câu 3 : Đáp án D
$MgO + H_2SO_4 \to MgSO_4 + H_2O$
$Mg + H_2SO_4 \to MgSO_4 + H_2$
$2Fe(OH)_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 6H_2O$
$2NaOH + H_2SO_4\to Na_2SO_4 + 2H_2O$
$BaCl_2 + H_2SO_4 \to BaSO_4 + 2HCl$
$Na_2CO_3 + H_2SO_4 \to Na_2SO_4 + CO_2 + H_2O$

a.
- Trích mẫu thử
- Cho nước vào các mẫu thử:
+ Nếu tan và có khí bay ra là Na
\(2Na+2H_2O--->2NaOH+H_2\)
+ Không tan là Al và Mg
- Cho NaOH vừa thu được sau phản ứng của Na và H2O vào 2 mẫu thử còn lại:
+ Nếu tan và có khí thoát ra là Al
\(Al+NaOH+H_2O--->NaAlO_2+\dfrac{3}{2}H_2\)
+ Không có hiện tượng là Mg

- Trích mẫu thử, đánh STT
- Hòa tan các kim loại vào nước nếu thấy:
+ Kim loại không tan: Ag
+ Kim loại tan, tạo dd không màu đồng thời có khí không màu, không mùi thoát
ra: Mg, Al, Fe
`Mg + H_2SO_4 -> MgSO_4 + H_2`
`2Al + 3H_2SO_4 -> Al_2(SO_4)_3 + 3H_2`
`Fe + H_2SO_4 -> FeSO_4 + H_2`
+ Kim loại tan, có khí không màu, không mùi bay lên đồng thời xuất hiện kết tủa màu trắng: Ba
\(Ba+H_2SO_4\rightarrow BaSO_4\downarrow+H_2\)
- Cho Ba tiếp vào dd H2SO4 loãng cho tới khi dư, lọc bỏ phần kết tủa thu được dd Ba(OH)2
- Cho dd Ba(OH)2 vào dd thu được của các kim loại còn lại, nếu thấy:
+ Có kết tủa trắng xuất hiện: dd MgSO4 -> kim loại ban đầu là Mg
\(MgSO_4+Ba\left(OH\right)_2\rightarrow BaSO_4\downarrow+Mg\left(OH\right)_2\downarrow\)
+ Có kết tủa trắng xuất hiện, sau đó tan ra một phần: dd Al2(SO4)3 -> kim loại ban đầu là Al
\(Al_2\left(SO_4\right)_3+3Ba\left(OH\right)_2\rightarrow2Al\left(OH\right)_3\downarrow+3BaSO_4\downarrow\\ Ba\left(OH\right)_2+2Al\left(OH\right)_3\rightarrow Ba\left(AlO_2\right)_2+4H_2O\)
+ Có kết tủa trắng xuất hiện, sau đó một phần hóa nâu đỏ ngoài không khí: dd FeSO4 -> kim loại ban đầu là Fe
\(FeSO_4+Ba\left(OH\right)_2\rightarrow Fe\left(OH\right)_2\downarrow+BaSO_4\downarrow\\ 4Fe\left(OH\right)_2+O_2+2H_2O\rightarrow4Fe\left(OH\right)_3\downarrow\)
- Dán nhãn
Nhận biết được Ba vì có kết tủa, khí thoát ra:
Ba + H2SO4 -> BaSO4 + H2
Nhận biết được Ag vì không có hiện tượng.
Các kim loại còn lại chưa nhận biết được vì đều tan tạo dung dịch trong suốt không màu
Cho Ba vào dd H2SO4 có kết tủa trắng BaSO4 và khí H2 bay lên
Fe, Mg, Al đều có khí bay lên và tạo thành dd không màu
Ag không tan trong H2SO4 loãng
Cho lượng dư Ba vào dd H2SO4 ta sẽ thu được Ba(OH)2. Cho Ba(OH)2 vào ba dd muối sunfat của Fe, Al, Mg. Dd có kết tủa trắng xanh sau đó hóa nâu là dd muối của Fe, dd có kết tủa keo sau đó tan là muối nhôm, dd có kết tủa trắng là muối của Mg